在免疫肿瘤治疗持续革新的时代背景下,复宏汉霖创新抗PD-L1/VEGF双特异性抗体HLX37获中国药监局批准开展临床试验的消息再次将PD-1/PD-L1免疫检查点靶向通路推向行业关注的焦点。作为连接免疫调控与肿瘤微环境血管生成的双靶点策略,PD-L1/VEGF双抗不仅延续了PD-1/PD-L1免疫抑制阻断的成功路径,也探索了免疫治疗与抗血管生成协同作用的新机制。这一进展不仅代表了国产创新生物药在全球免疫肿瘤领域的话语权提升,也反映出在单抗疗效面临耐药与应答率差异挑战时,更深层次理解PD-1/PD-L1通路的结构、表达调控和信号机制对于新型药物设计与精准治疗策略至关重要。
一、PD-1与PD-L1靶点概述
程序性细胞死亡蛋白-1(Programmed Cell Death Protein 1,PD-1,基因名PDCD1)是一种重要的免疫抑制性受体,主要表达于活化后的T细胞表面,同时也可在B细胞、自然杀伤细胞(NK细胞)以及部分树突状细胞中检测到。PD-1最早于1992年被发现,最初被认为与细胞凋亡相关,随后研究逐渐明确其在免疫负调控中的关键作用[1]。
PD-1的主要配体包括PD-L1(Programmed Death-Ligand 1,又称B7-H1,基因名CD274)和PD-L2(B7-DC)。其中,PD-L1的研究和临床意义最为突出。PD-L1不仅表达于抗原提呈细胞(如树突状细胞、巨噬细胞、B细胞),还可在多种非免疫细胞及肿瘤细胞中诱导表达。肿瘤细胞通过高表达PD-L1,与T细胞表面的PD-1结合,从而抑制抗肿瘤免疫反应,形成经典的“免疫逃逸”机制[2]。
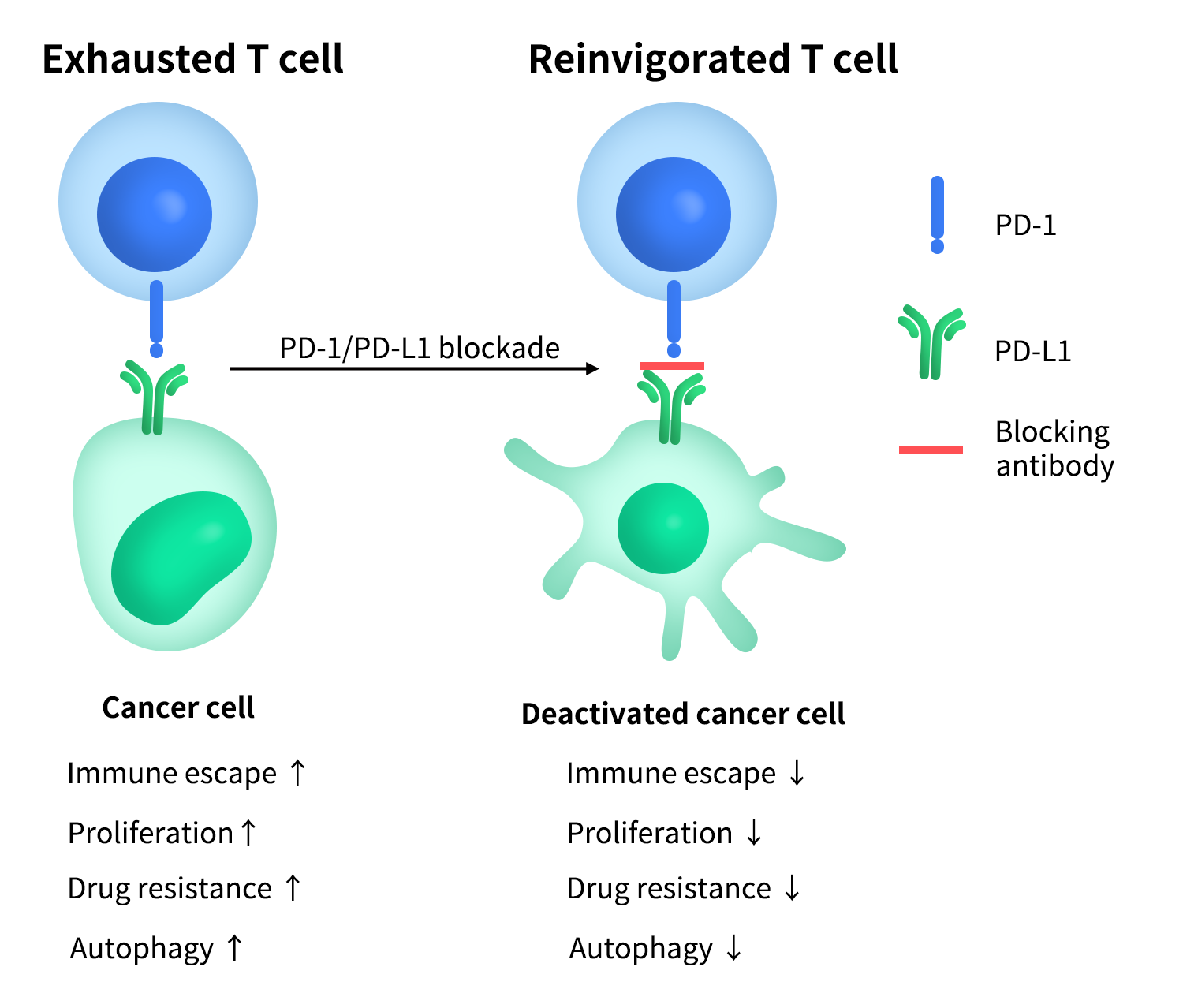
Figure 1.PD-1 & PD-L1 ‘immune evasion’ mechanism
基于这一生物学基础,PD-1/PD-L1通路成为当前肿瘤免疫治疗中最重要、最成熟的免疫检查点靶点之一,相关单克隆抗体已在多种肿瘤适应症中取得突破性疗效。
二、PD-1与PD-L1的结构特征
PD-1与 PD-L1构成了一对典型的免疫检查点分子,其结构特征直接决定了二者的结合方式及免疫抑制功能。总体而言,PD-1是一种以免疫受体样结构为核心、负责信号转导的跨膜受体,而PD-L1则是以免疫球蛋白样折叠为主、负责配体识别与结合的跨膜配体,二者在胞外区形成特异而相对平坦的蛋白–蛋白相互作用界面。
2.1 PD-1的分子结构
PD-1属于I型跨膜蛋白,其整体结构可划分为三个功能区段:胞外区由一个V-set型免疫球蛋白样结构域构成,是PD-1与PD-L1/PD-L2发生特异性结合的关键区域;跨膜区为单次跨膜的α螺旋结构,负责将胞外配体结合事件与胞内信号转导相耦联;胞内区虽然长度较短,但功能高度集中,包含两个关键酪氨酸基序,即ITIM(Immunoreceptor Tyrosine-based Inhibitory Motif)和ITSM(Immunoreceptor Tyrosine-based Switch Motif),其中ITSM被认为是介导PD-1抑制性信号转导的核心功能位点。与经典激活型免疫受体不同,PD-1自身不具备内在激酶活性,其免疫抑制功能完全依赖胞内基序在受体激活后对SHP-2等下游信号分子的招募能力。
2.2 PD-L1的分子结构
PD-L1同样属于I型跨膜蛋白,其胞外区由两个免疫球蛋白样结构域组成(IgV+IgC),其中IgV结构域不仅直接参与与PD-1的结合,也可介导其与B7-1(CD80)的相互作用。多项晶体学和冷冻电镜研究已解析了人源PD-1/PD-L1复合物的高分辨率结构,系统阐明了二者的结合界面、空间构象特征及关键氨基酸残基,为理解PD-L1在免疫抑制与免疫调控中的双重作用提供了重要的结构基础[3,4]。
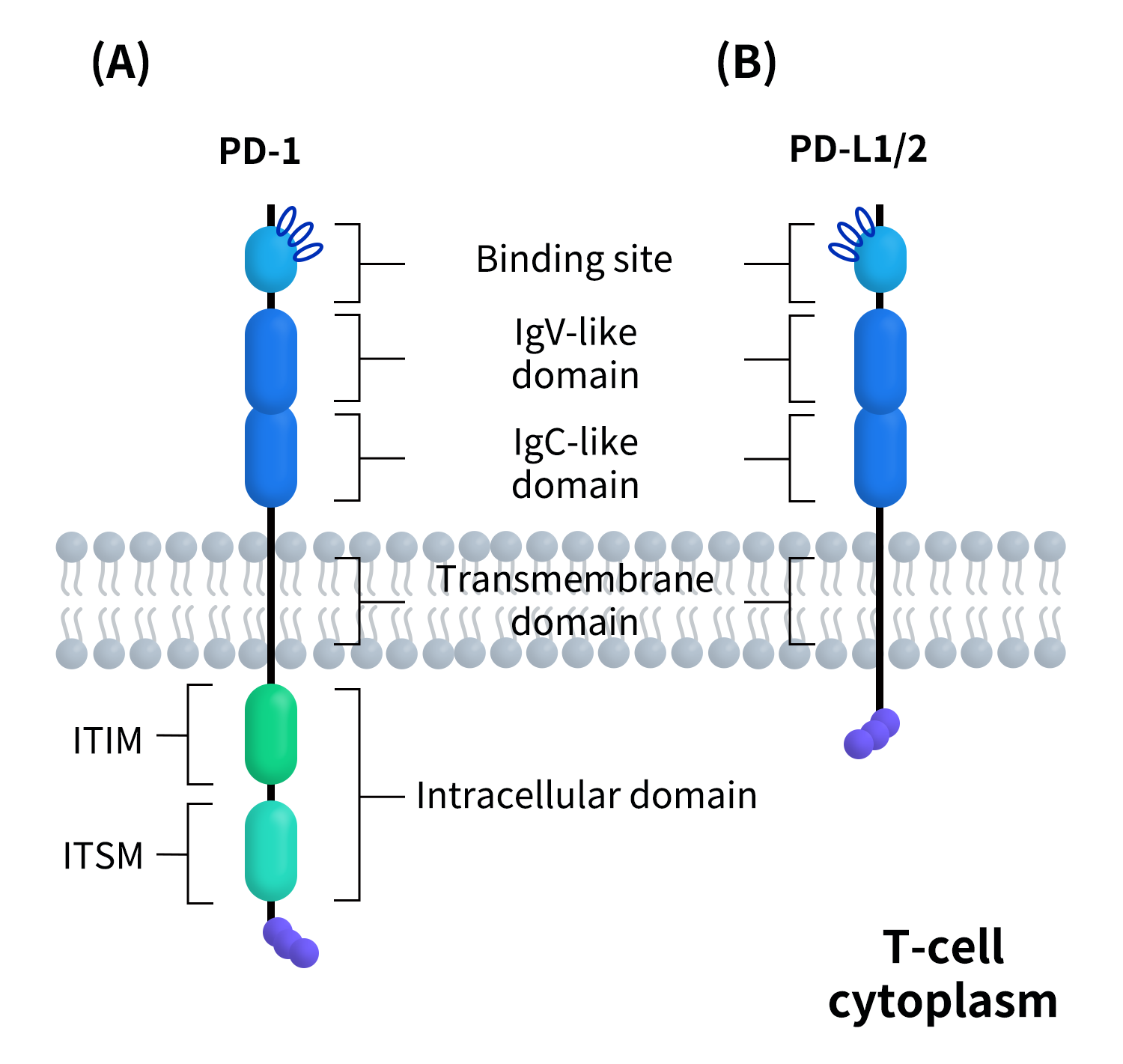
Figure 2.The structure of PD-1&PD-L1
三、PD-1/PD-L1组织分布与表达
在正常生理条件下,PD-1/PD-L1通路的表达具有明显的细胞类型和组织特异性,其分布特征与维持外周免疫耐受、防止过度免疫反应密切相关;而在肿瘤及慢性炎症状态下,该通路常被异常激活并显著上调,成为免疫逃逸的重要分子基础。
3.1 PD-1的表达特征
在稳态条件下,初始T细胞中PD-1表达水平较低甚至不可检测。当T细胞经抗原刺激并发生激活后,PD-1表达迅速上调,作为一种负反馈机制限制过度免疫反应。在急性感染清除后,PD-1表达可随免疫应答终止而逐步下降。
然而,在肿瘤或慢性感染(如病毒持续感染)背景下,抗原刺激长期存在,PD-1往往持续高表达,成为T细胞耗竭的重要分子标志之一。
3.2 PD-L1的诱导性表达
与PD-1相比,PD-L1的表达调控更加复杂。炎症因子,尤其是IFN-γ,被认为是诱导PD-L1表达的最重要上游信号。肿瘤微环境中,肿瘤细胞、肿瘤相关巨噬细胞以及成纤维细胞在IFN-γ、TNF-α等刺激下,可显著上调PD-L1,从而形成对局部免疫反应的强抑制状态[2]。
此外,PD-L1的表达还受到多种非炎症因素调控,包括基因扩增、转录因子(如STAT3、HIF-1α)激活以及表观遗传修饰等,这也解释了部分肿瘤中PD-L1的高表达并不完全依赖免疫炎症背景。
四、PD-1/PD-L1信号通路机制
PD-1/PD-L1通路的核心功能在于对T细胞受体(TCR)介导的激活信号进行“刹车式”调控,其信号机制主要依赖PD-1胞内区的ITSM基序。
4.1 信号起始:配体结合与酪氨酸磷酸化
当PD-1与PD-L1或PD-L2结合后,PD-1胞内尾部的ITSM基序发生磷酸化。该磷酸化事件为下游含SH2结构域的蛋白提供结合位点,是抑制性信号传导的起点[5]。
4.2 SHP-2招募与关键信号分子抑制
磷酸化后的ITSM主要招募蛋白酪氨酸磷酸酶SHP-2(在部分情境下也可观察到SHP-1的参与)。SHP-2通过去磷酸化作用,抑制多条与T细胞激活密切相关的信号通路,包括:
- TCR-CD3-ZAP70通路:降低TCR信号强度;
- CD28共刺激通路:抑制共刺激信号是PD-1抑制作用的重要机制之一;
- PI3K–AKT–mTOR通路:影响T细胞代谢、存活与增殖;
- RAS–MEK–ERK通路:抑制转录因子AP-1的激活。
这些信号的综合抑制导致T细胞IL-2等细胞因子分泌减少、增殖能力下降,效应功能受限[5,6]。
4.3 T细胞耗竭与代谢重编程
在慢性感染或肿瘤等持续抗原刺激条件下,PD-1的长期高表达与信号激活会驱动T细胞进入“耗竭(Exhaustion)”状态,其特征包括细胞毒性下降、细胞因子产生减少以及代谢能力受损。研究表明,PD-1信号可显著抑制糖酵解并影响线粒体功能,从代谢层面限制T细胞的持续效应活性[7]。
4.4 与其他免疫检查点的协同
值得注意的是,PD-1/PD-L1并非孤立发挥作用。其信号通路与CTLA-4、LAG-3、TIM-3等其他免疫检查点在功能上存在交叉与协同,这也是联合免疫治疗策略不断发展的重要理论依据[2]。关于靶向PD-1与PD-L1的差异>>
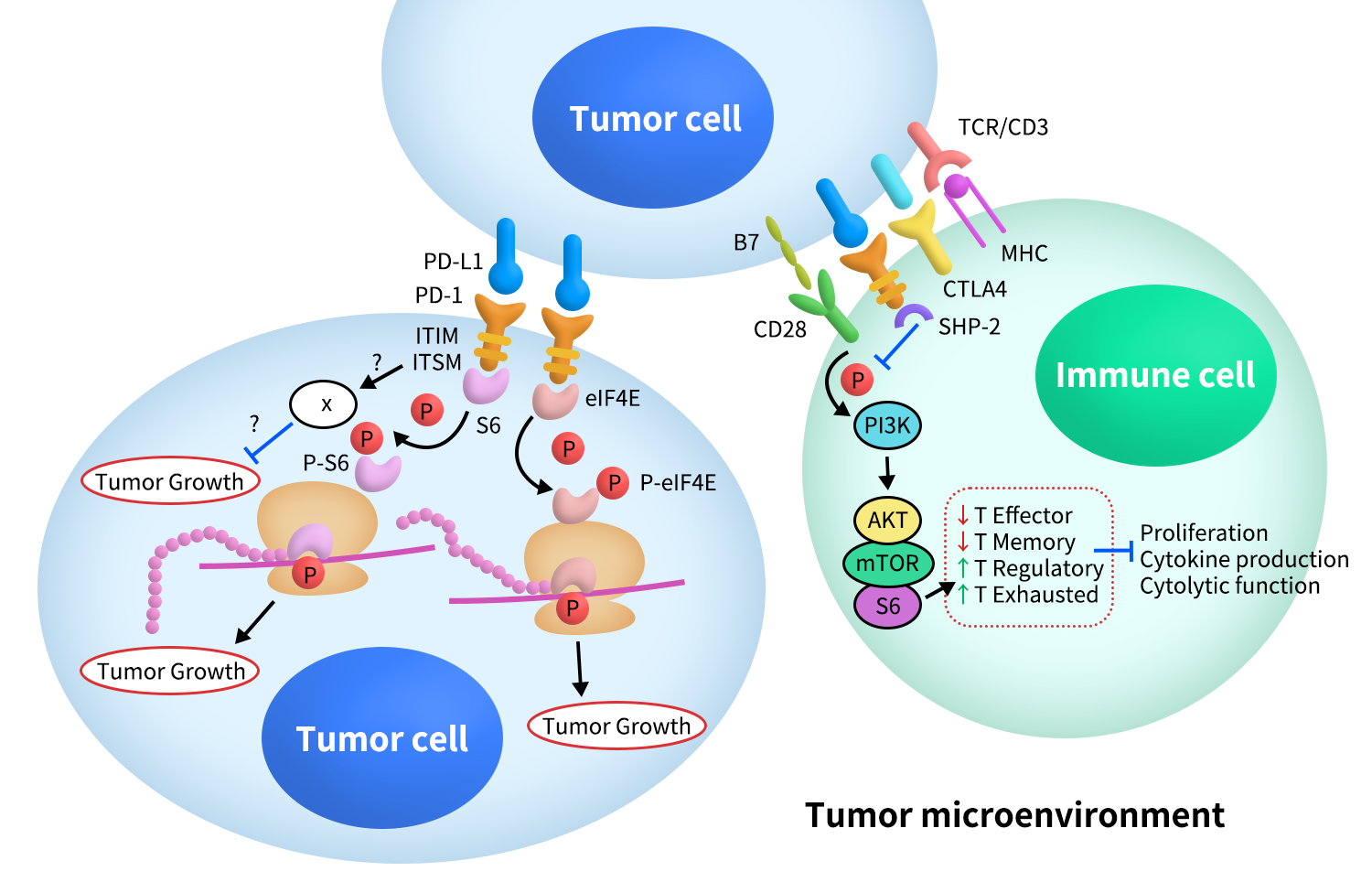
Figure 3.The Signaling of PD-1&PD-L1
五、PD-1/PD-L1相关的疾病
PD-1和PD-L1通路是免疫系统调节的一部分,尤其在维持免疫耐受与免疫逃逸中起着关键作用。它们通过相互作用抑制T细胞的功能,从而抑制过度的免疫反应。这一机制虽然在防止自身免疫和过度免疫反应中有重要作用,但也被肿瘤细胞利用,帮助其逃避宿主的免疫监视。因此,PD-1/PD-L1的异常调节与多种疾病的发生密切相关,既包括癌症,也包括自身免疫疾病、移植排斥反应等。(关于PD-1靶向药物类型全梳理>>) (关于PD-L1靶向药物的多技术路线布局>>)
5.1 癌症:免疫逃逸的主要机制
癌症细胞利用PD-1/PD-L1信号通路逃避免疫系统的监视。正常情况下,T细胞通过识别癌细胞表面或其内部的异常抗原来进行免疫杀伤。然而,许多肿瘤细胞通过上调PD-L1的表达,阻断T细胞的功能,避免被免疫系统清除。肿瘤细胞通过与T细胞表面的PD-1结合,抑制了T细胞的激活和增殖,使得癌细胞能够逃避免疫监视和攻击。相关肿瘤类型包括:
- 非小细胞肺癌(NSCLC):非小细胞肺癌是最早被应用免疫检查点抑制剂的癌症之一。研究发现,PD-L1的表达与非小细胞肺癌的免疫逃逸密切相关,抗PD-1抗体(如纳武利尤单抗)显著提高了这些患者的生存率。
- 黑色素瘤:黑色素瘤患者通常PD-L1表达较高,因此抗PD-1治疗,如派姆单抗(Keytruda)和纳武利尤单抗,已成为黑色素瘤的重要治疗方案。
- 头颈鳞状细胞癌:PD-1/PD-L1抑制剂已经成为头颈鳞状细胞癌的重要治疗选择,特别是对于那些PD-L1表达较高的患者。
- 膀胱癌、肾细胞癌:PD-1/PD-L1抑制剂在膀胱癌和肾细胞癌中也显示了良好的疗效,尤其是对于那些传统治疗失败的患者。
免疫检查点抑制剂通过解除PD-1/PD-L1的抑制作用,恢复T细胞的抗肿瘤功能,成为治疗这些肿瘤的突破性方法。
5.2 免疫相关疾病:PD-1/PD-L1失调与自体免疫反应
PD-1/PD-L1通路不仅在肿瘤免疫逃逸中起重要作用,还与多种自身免疫疾病的发展密切相关。自身免疫疾病通常是由于免疫系统攻击自身组织,造成炎症和损伤。PD-1/PD-L1通路的失调可以导致免疫系统的过度活跃,进而触发这些疾病。相关疾病包括:
- 系统性红斑狼疮(SLE):SLE是一种典型的自身免疫性疾病,其中免疫系统攻击正常组织。研究表明,PD-1的表达在SLE患者中常常减少,而PD-L1的功能失调可能促进了免疫细胞对正常组织的攻击。某些SLE患者中,PD-1缺乏或其信号通路的抑制可能与疾病的活动性和症状的加重相关。
- 类风湿性关节炎:在类风湿性关节炎患者中,T细胞对关节组织的攻击会导致慢性炎症。PD-1的功能障碍可能与T细胞在关节中的异常激活有关。因此,PD-1/PD-L1的调节可能成为治疗类风湿性关节炎的一个潜在目标。
- 多发性硬化症(MS):多发性硬化症是中枢神经系统的自身免疫性疾病,PD-1/PD-L1通路在MS的发病机制中也发挥重要作用。研究发现,PD-1在MS患者中表现出功能障碍,可能导致自体免疫反应的失调,从而引发神经系统损伤。
- 糖尿病Ⅰ型:糖尿病Ⅰ型是由免疫系统攻击胰岛β细胞引起的,PD-1/PD-L1的调节缺陷被认为与这种疾病的发生有关。在某些动物模型中,恢复PD-1的功能可减少β细胞的破坏,减缓疾病的进展。
5.3 PD-1/PD-L1器官移植中的作用
在器官移植中,PD-1/PD-L1信号通路也发挥着重要作用。在移植过程中,接受者的免疫系统可能将移植物视为外来物,并启动免疫反应引发排斥。PD-1/PD-L1信号通路可以帮助免疫系统识别并适应这些外来组织,防止排斥反应的发生。研究表明,PD-L1在调节移植免疫耐受中扮演着关键角色。在一些移植患者中,通过调节PD-1/PD-L1通路,可以有效抑制排斥反应并促进移植物的长期存活。
PD-1/PD-L1作为免疫检查点分子,已经成为癌症免疫治疗的核心靶点,并且取得了显著的临床成果。通过阻断PD-1与PD-L1的相互作用,可以有效解除对T细胞的抑制,恢复其抗肿瘤免疫功能。基于该机制的免疫检查点抑制剂已广泛应用于黑色素瘤、非小细胞肺癌、肾细胞癌、霍奇金淋巴瘤等多种肿瘤类型,显著改善了部分患者的长期生存[8]。
与此同时,耐药机制、疗效预测生物标志物以及免疫相关不良反应(irAEs)仍是该领域的研究热点,这些问题的深入研究高度依赖于高质量的PD-1/PD-L1蛋白与抗体试剂。
六、缔码PD-1/PD-L1相关蛋白与抗体产品支持
围绕PD-1/PD-L1靶点研究,缔码可提供一系列针对PD-1/PD-L1靶点的重组蛋白和单克隆抗体,涵盖人、鼠、犬等多个物种。这些产品广泛应用于免疫检查点研究、免疫治疗开发、抗体筛选、药物筛选及机制研究,帮助科研人员深入探索PD-1/PD-L1通路的功能及其在癌症免疫治疗中的作用。我们的高质量产品为您提供可靠的实验支持,助力相关领域的科研进展。
- PD-1/PD-L1靶点相关产品
|
Target |
Product_Type |
SKU |
Product name |
|
PD-1 |
ECD Proteins |
PME100025 |
|
|
|
|
PME100461 |
|
|
|
|
PME100462 |
|
|
|
|
PME-M100099 |
|
|
|
|
PME-D100005 |
|
|
|
|
PME-D100006 |
|
|
|
|
PME-D100008 |
|
|
|
|
PME101789 |
|
|
|
Monoclonal antibodies |
DME100177 |
|
|
|
|
DME100177B |
|
|
|
|
DME101041 |
|
|
|
|
DME101041B |
|
|
PD-L1 |
ECD Proteins |
PME100023 |
|
|
|
|
PME100480 |
|
|
|
|
PME-M100077 |
|
|
|
|
PME-C100021 |
|
|
|
|
PME-D100007 |
|
|
|
|
PME-D100009 |
|
|
|
|
PME101591 |
|
|
|
|
PME101592 |
|
|
|
|
PME101706 |
|
|
|
Monoclonal antibodies |
DME100123 |
|
|
|
|
DME100124 |
|
|
|
|
DMC100875 |
|
|
|
|
DME100123B |
|
|
|
|
DME100124B |
|
|
|
|
DMC100875B |
|
|
PD-L2 |
ECD Proteins |
PME100518 |
|
|
|
Monoclonal antibodies |
DME100169 |
|
|
|
|
DME100169B |
|
|
|
|
DME100169P |
|
|
B7-1/CD80 |
ECD Proteins |
PME100473 |
|
|
|
|
PME100047 |
|
|
|
|
PME-M100044 |
|
|
|
Monoclonal antibodies |
DME100109 |
|
|
|
|
DME100110 |
|
|
|
|
DME100111 |
|
|
|
|
DME100109B |
|
|
|
|
DME100110B |
|
|
|
|
DME100111B |
|
|
|
|
DME100109P |
- PD-1/PD-L1靶点先导抗体进度

参考文献
- Ishida Y, Agata Y, Shibahara K, Honjo T. Identification of PD-1 as a novel immunoregulatory receptor. Journal of Experimental Medicine. 1992.
- Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 2015.
- Zak KM, Kitel R, Przetocka S, et al. Structure of the complex of human PD-1 and PD-L1. Structure. 2015.
- Lin DY, Tanaka Y, Iwasaki M, et al. The PD-1/PD-L1 complex resembles the antigen-binding Fv domains of antibodies. Proceedings of the National Academy of Sciences USA. 2008.
- Okazaki T, Honjo T. PD-1 and PD-1 ligands: from discovery to clinical application. International Immunology. 2007.
- Strazza M, Azoulay-Alfaguter I, Peled M, et al. SHP-2 suppresses T cell activation downstream of PD-1. Nature Immunology. 2021.
- Patsoukis N, Bardhan K, Chatterjee P, et al. PD-1 alters T-cell metabolic reprogramming. Nature Immunology. 2015.
- Han Y, Liu D, Li L. PD-1/PD-L1 pathway: current researches in cancer. American Journal of Cancer Research. 2020.


