髓系细胞触发受体2(TREM2)近年来成为神经退行性疾病领域的明星靶点。自2013年NEJM与Nature报道TREM2基因的罕见错义突变(如R47H)显著增加阿尔茨海默病发生风险以来,该受体迅速成为神经免疫领域的研究焦点。近两年来,这一靶点迅速从基础研究走向临床:口服小分子激动剂VG-3927完成一期受试者给药并显示良好安全性,计划进入二期试验;而单克隆抗体iluzanebart在临床试验中未达终点被迫终止,显示该靶点虽充满潜力,但临床探索仍面临重大挑战。基于这些突破与挫折,本综述将系统梳理TREM2的基因与结构、表达分布、功能与作用机制、相关疾病及在研药物进展,为理解其科学价值与临床潜力提供全景视角。
1、TREM2与其家族
TREM2是一种隶属于免疫球蛋白超家族(immunoglobulin superfamily, IgSF)的单次跨膜受体,属于触发受体家族(TREM family)。该家族最早于2000年被鉴定,成员主要由与主要组织相容性复合体(MHC)相关的基因簇编码,可分为激活型和抑制型亚型,目前已报道的成员包括TREM1(CD354)、TREM2、TREM3、TREM4、浆细胞样树突状细胞相关TREM(pDC-TREM)以及TREM-like transcripts(TLT-1和TLT-2)。其中,TREM2被认为主要发挥免疫抑制和稳态调节作用,近年来在神经系统疾病研究中受到广泛关注。
2、TREM2蛋白结构
人类TREM2基因位于染色体6p21.1,全长约4676 bp,由5个外显子组成,编码一个由230 个氨基酸组成的蛋白质。TREM2是典型的I型单次跨膜Ig超家族成员,最初作为TREM1的同源分子被克隆鉴定。其蛋白结构可划分为四个区域:N端信号肽(1-18 aa)、胞外结构域(19-173 aa)、单次跨膜螺旋区(174-195 aa)以及短胞质尾部(196-230 aa)。其中,胞外结构域包含V型免疫球蛋白样结构域(IgV)及短柄区,IgV负责结合多种配体(如磷脂、APOE、Aβ寡聚体及凋亡细胞碎片);短柄区富含O-糖基化位点,是ADAM10/17蛋白酶进行蛋白水解切割并释放sTREM2的主要位点;跨膜结构域包含一个带正电荷的赖氨酸残基,介导与信号转导蛋白DAP12(带有负电荷的天冬氨酸)的非共价结合;胞内短尾不具备自主信号传导能力,必须依赖DAP12的胞内免疫受体酪氨酸活化基序(ITAM)来传递下游信号。
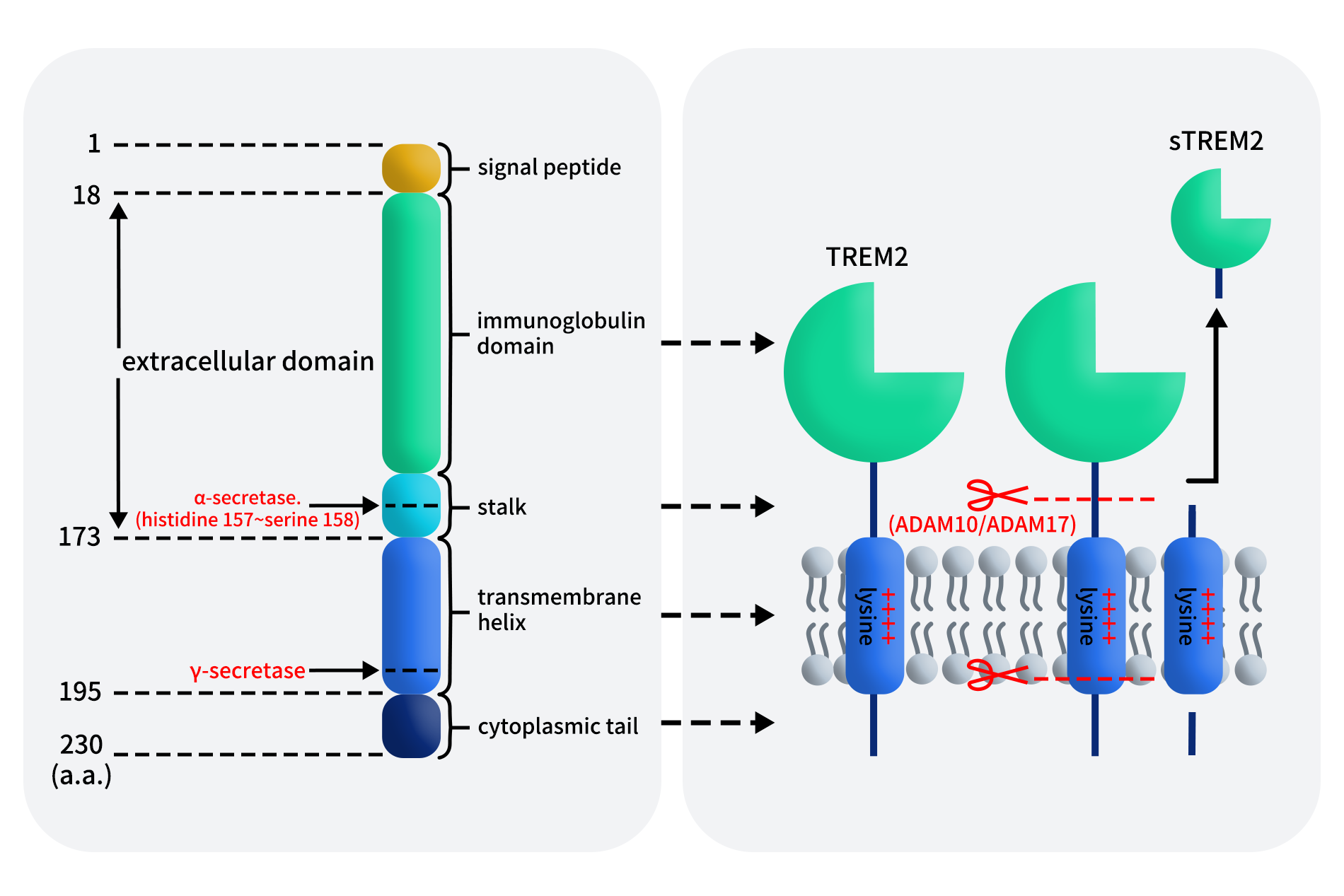
Figure 1. Schematic representation of TREM2 structure [1]
除膜结合形式外,TREM2还可通过胞外结构域的蛋白水解剪切生成可溶性TREM2(soluble TREM2, sTREM2)。研究表明,金属蛋白酶家族成员ADAM10与ADAM17可在第157与158位氨基酸位点切割TREM2,释放sTREM2,而残余的跨膜片段随后可被γ-分泌酶进一步水解。目前,是否存在其他蛋白酶参与 TREM2的剪切过程仍有待进一步研究。
3、TREM2分布与功能
TREM2 主要表达于髓系细胞系统,在中枢神经系统中以小胶质细胞表达最为显著,在外周组织中亦可见于巨噬细胞、单核细胞及破骨细胞等细胞类型。由于这些细胞在先天免疫、防御反应及组织稳态维持中发挥关键作用,TREM2 被认为是连接免疫感知与功能执行的重要受体之一。
在生理条件下,TREM2 参与调控髓系细胞对微环境变化的应答,支持其迁移、存活及清除功能。在中枢神经系统中,TREM2 有助于小胶质细胞识别并处理细胞碎片、异常蛋白聚集物等潜在有害信号,从而维持神经组织稳态;在外周组织中,TREM2 相关功能与吞噬作用、组织重塑及炎症反应调节密切相关。此外,TREM2 还被认为在限制过度炎症反应、促进免疫反应由激活向恢复阶段过渡的过程中发挥重要作用。正是基于其独特的表达分布和生理功能,TREM2 被视为多种神经系统疾病和免疫相关疾病中的关键调控分子 [2]。
4、TREM2/DAP12信号通路
如前所述,TREM2的胞质尾部极短,自身不具备独立的信号转导能力,其生物学功能必须依赖跨膜适配蛋白DAP12介导。在结构上,TREM2通过跨膜区中带正电的氨基酸残基与DAP12跨膜区中带负电的残基配对,形成稳定的TREM2/DAP12 信号复合体。DAP12以二硫键连接的同源二聚体形式存在,其胞内结构域包含ITAM,是TREM2向细胞内传递信号的核心模块。
当配体结合TREM2后,DAP12的ITAM基序发生酪氨酸磷酸化,继而招募并激活Syk激酶,启动多条下游信号通路,包括ERK、PI3K、PLCγ及Vav等,从而调控免疫细胞的存活、迁移、吞噬活性及功能状态。与此同时,TREM2/DAP12信号还可与集落刺激因子1受体(CSF1R)通路发生串扰,CSF1R信号中的Src激酶能够直接磷酸化DAP12的ITAM基序,实现多受体信号的整合与放大。
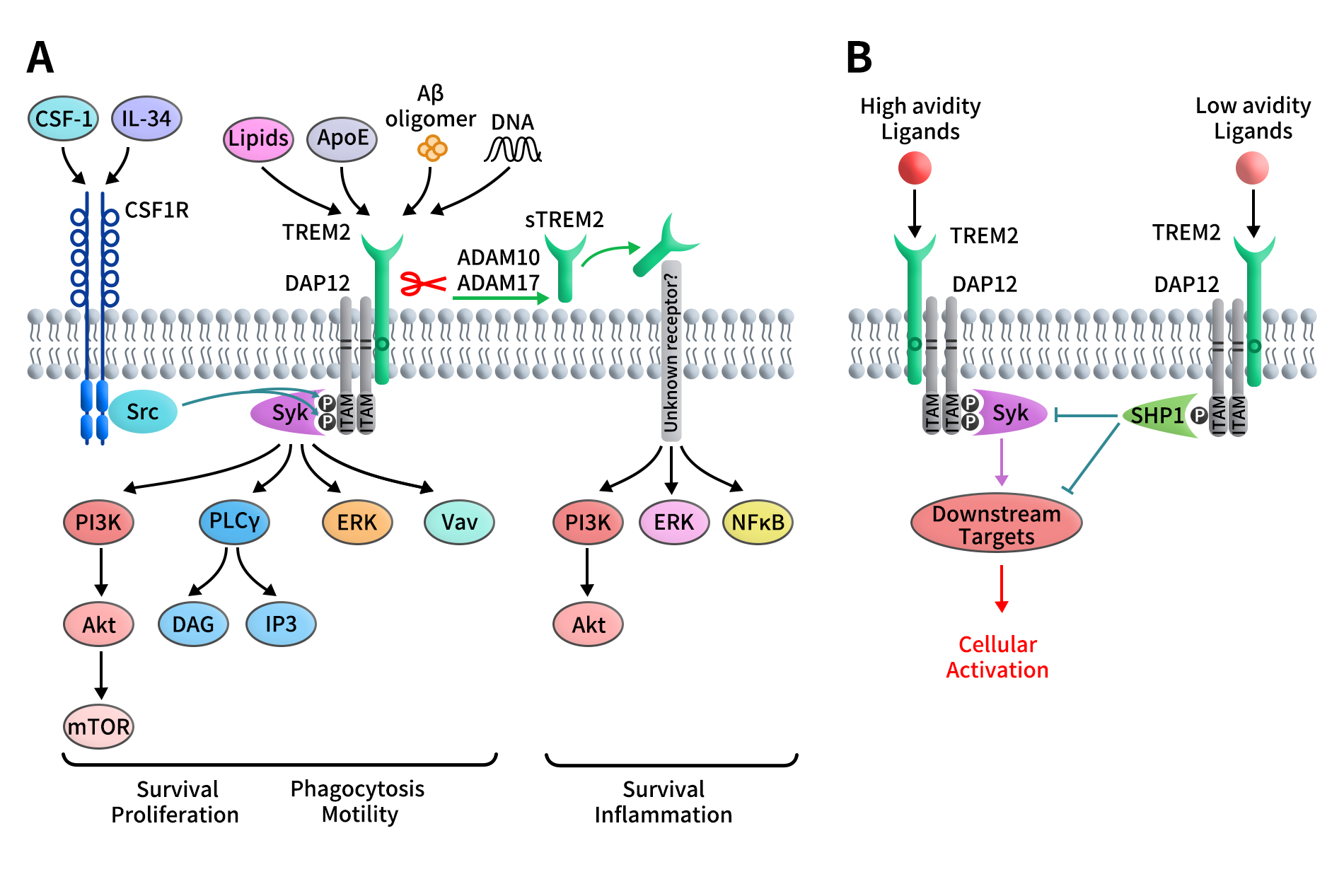
Figure 2. Schematic representation of the TREM2/DAP12 signaling pathway [3]
值得注意的是,尽管ITAM通常被视为激活型信号元件,TREM2/DAP12轴在不同配体条件下可呈现激活或抑制的双重功能。当高亲和力或高结合强度的配体与TREM2结合时,ITAM发生完全磷酸化,Syk信号被有效激活,驱动促激活反应;而在低亲和力或低结合强度配体条件下,ITAM仅发生部分磷酸化,从而招募蛋白酪氨酸磷酸酶SHP-1,抑制Syk下游信号,限制细胞过度激活。该“信号强度依赖型”调控机制,为TREM2在免疫稳态及炎症相关疾病中的功能多样性提供了分子基础。
5、TREM2与疾病
TREM2是小胶质细胞(microglia)上的关键免疫受体,包含膜结合型TREM2(mTREM2)和可溶型TREM2(sTREM2)两种形式。其中,mTREM2 通过DAP12介导ITAM信号转导,调控小胶质细胞的吞噬活性、炎症反应及神经稳态,是阿尔茨海默病(AD)、帕金森病(PD)、前额叶痴呆(FTD)等中枢神经系统疾病密切相关的功能型受体。mTREM2功能障碍或突变可导致小胶质细胞清除 β-淀粉样蛋白能力下降,加速病理沉积和认知功能恶化;在PD等神经退行性疾病中,通过调控炎症反应,mTREM2有助于保护神经元免受损伤。sTREM2虽不直接传导胞内信号,但可作为小胶质细胞活化和疾病进展的生物标志物。由于mTREM2 在疾病相关病理中的核心功能,它被认为是神经退行性疾病治疗的重要靶点。近年来,针对 TREM2 的药物开发逐渐展开,包括激动性抗体、可调节小分子及双特异性抗体等策略,这些策略旨在增强 mTREM2 功能并调控小胶质细胞活化状态,为相关疾病提供新的治疗途径。
6、靶向TREM2药物研究进展
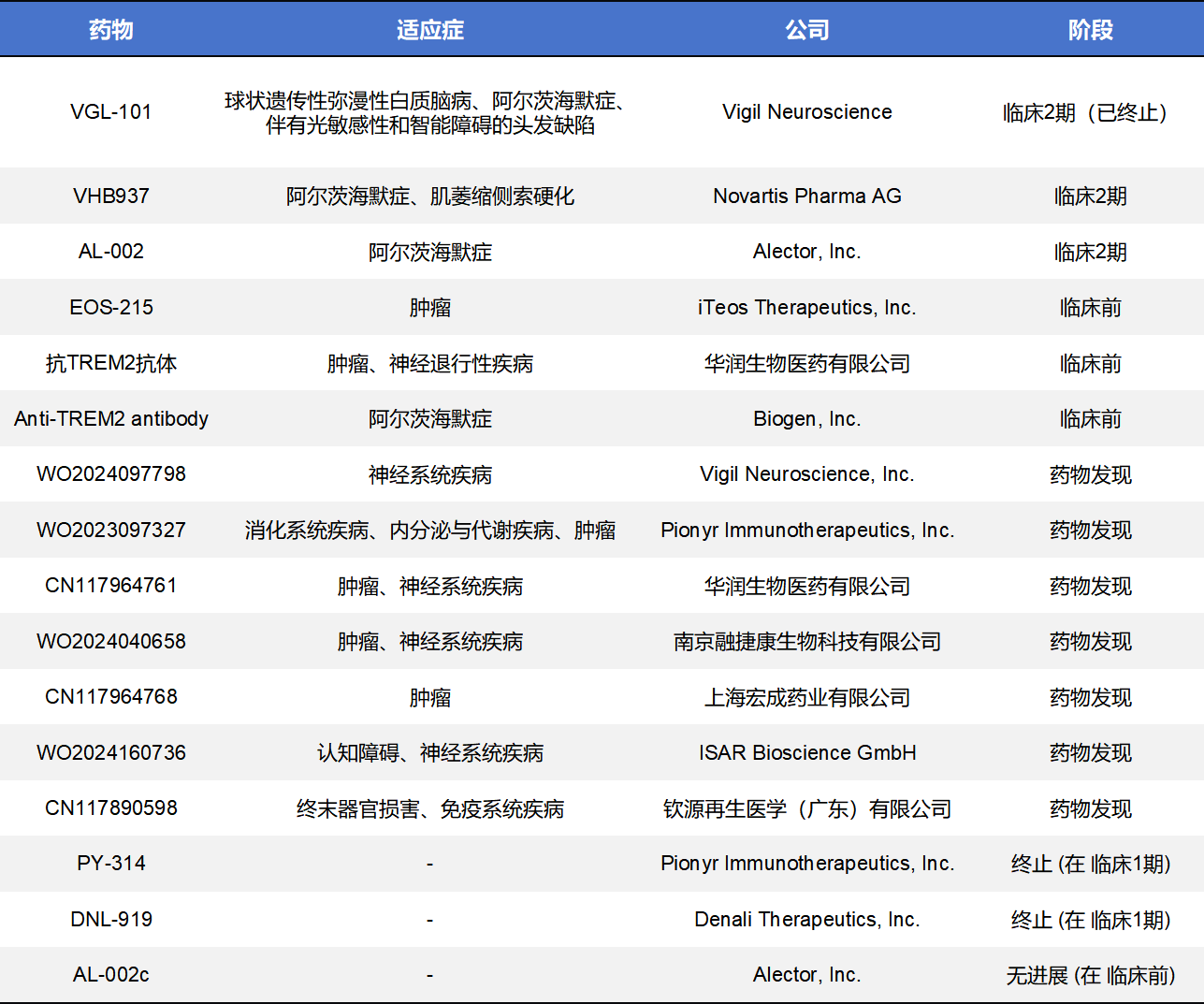
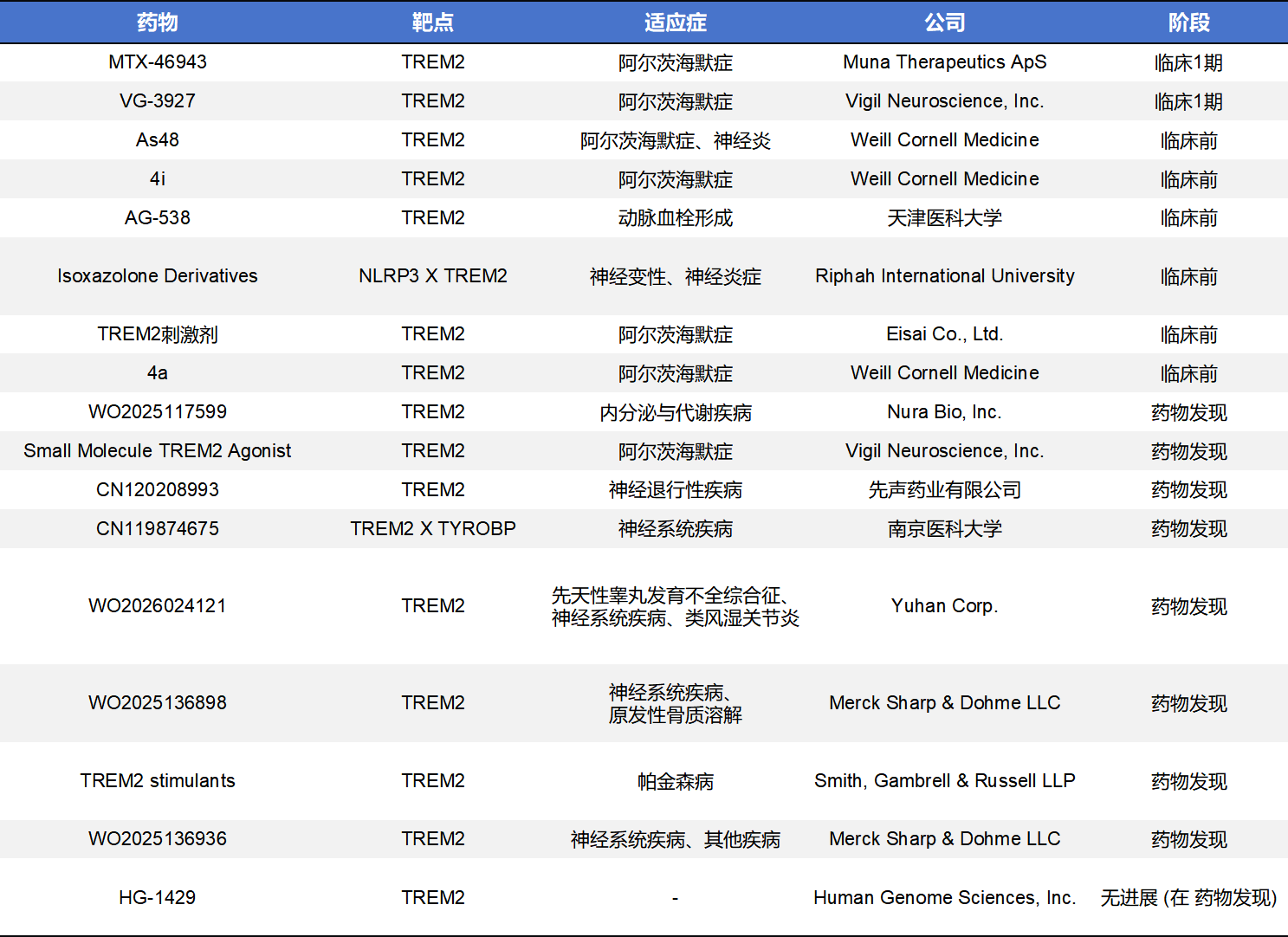
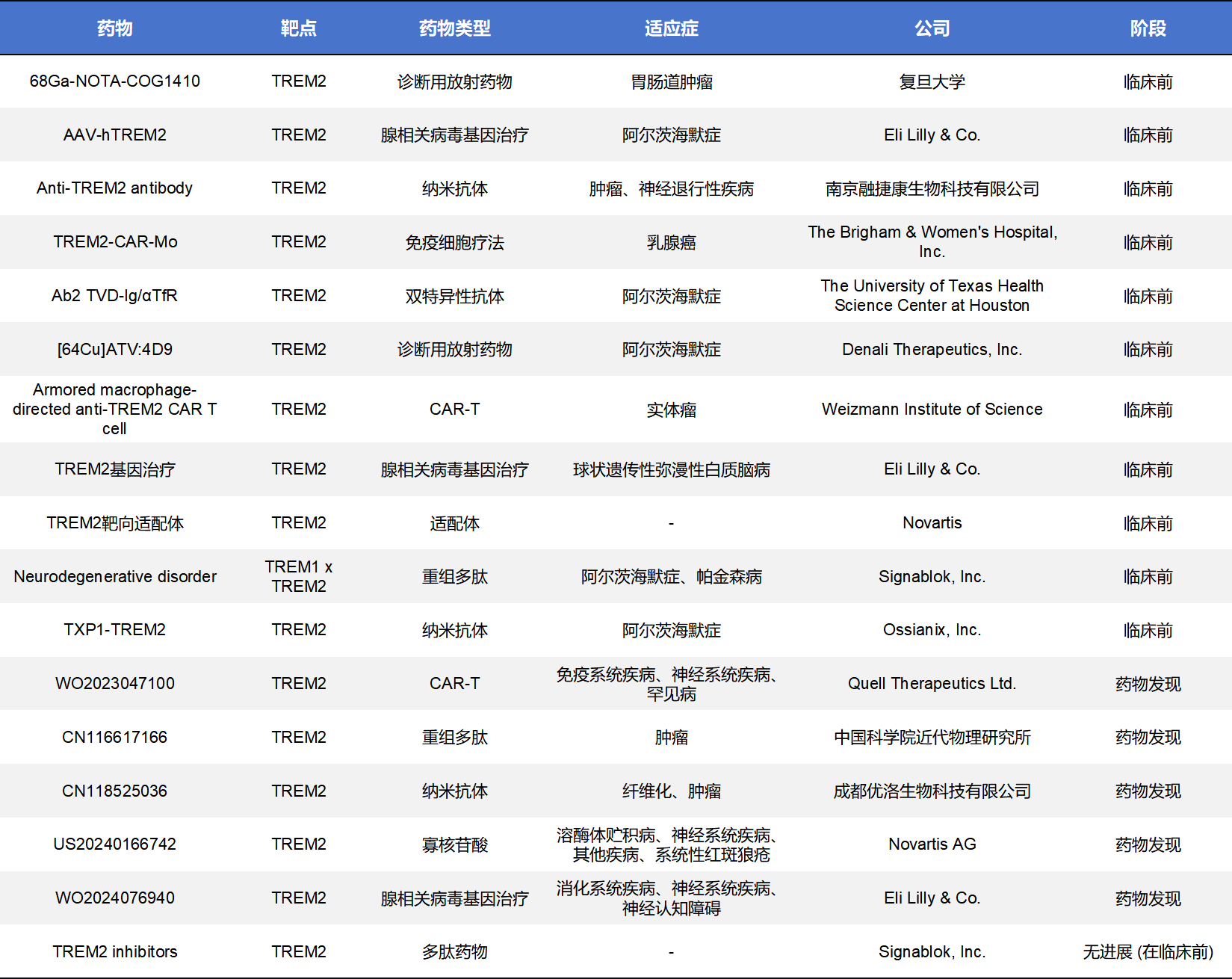
目前,TREM2药物开发主要集中在激动型单克隆抗体和小分子化药两个方向,CAR-T、纳米抗体、重组多肽等方向也有TREM2药物布局,但是均处于临床前或者药物研发阶段。不完全统计,当前全球共有50款TREM2药物,其中20款处于临床前,20款处于药物发现,进入临床阶段的仅5款,剩余5款处于无进展或终止状态。
6.1 TREM2单克隆抗体
截至2025年初,全球约有3款针对TREM2的激动型单克隆抗体已进入临床研究阶段,由Alector、Vigil Neuroscience和Novartis等领跑,形成了从阿尔茨海默病(AD)到成人起病的白质脑病(ALSP)等多适应症的临床布局。但大部分药仍处于临床前和药物发现阶段。
- AL002是Alector自主研发的一款处于Phase 2 (INVOKE-2)临床阶段的TREM2激动型抗体,是目前全球临床进展最快的一款。该项目是2017年Alector与AbbVie价值高达05亿美元首付款BD合作的一部分。AL002已获得美国FDA的快速通道认定。最新的临床中期分析显示,AL002能显著提升脑脊液中TREM2激活相关的生物标志物水平(如sCSF1R),证明了其强大的靶点占有率及小胶质细胞激活能力。
- VGL101,又称为Iluzanebart,这是一款针对TREM2IgV结构域的单克隆抗体,由Vigil Neuroscience开发,目前处于Phase 2临床阶段。其首选适应症为罕见病成人起病的具有轴突球蛋白和色素胶质细胞的ALSP,并已获得FDA的孤儿药认定及快速通道认定。2025年6月4日,Vigil Neuroscience发布更新公告称,其针对ALSP的II期IGNITE临床试验评估对象 iluzanebart的最终数据分析显示,在主要生物标志物和临床疗效终点方面未观察到有益效果。公司已根据先前披露的流程决定终止该 II 期试验的长期延伸研究。
- VHB937原由Pliant Therapeutics开发,后由Novartis通过高达11.2亿美元的潜在交易总额获得全球授权,目前处于Phase 2临床阶段。VHB937是一种高亲和力的激动型抗体,旨在通过稳定膜表面TREM2的结构并抑制其蛋白水解脱落,从而增强小胶质细胞的存活信号。2025年初,诺华已正式启动其针对肌萎缩侧索硬化症(ALS)及其他神经变性疾病的扩展临床研究,探索其在减少蛋白聚集物方面的疗效。
6.2 TREM2小分子化药
目前TREM2小分子化药研发已正式进入临床阶段,全球约有2款药物率先进入临床,分别是由Muna Therapeutics ApS开发的MNA-001和Vigil Neuroscience开发的VG-3927,主打口服便捷性与高血脑屏障渗透率。与TREM2单克隆抗体药物一样,绝大部分还是处于临床前和药物发现阶段。
- MNA-001是一款由Muna Therapeutics开发的TREM2小分子化药,2025年初宣布完成Phase 1首例给药,针对早期AD。该药物于2026年1月获得阿尔茨海默病协会100万美元资助,用于验证其在人类中的药效生物标志物。
- VG-3927 是由Vigil Neuroscience自主研发的一款TREM2小分子化药。作为首个进入临床的小分子TREM2激动剂,Sanofi于2025年5月以约7亿美元完成对Vigil对应管线的收购。VG-3927在 Phase 1 研究中表现出优异的安全性和靶点占有率,被视为挑战诺华抗体药物地位的有力竞争者。
6.3 TREM2的其他策略
除主流的单抗与小分子外,TREM2靶点正吸引更多元化的技术平台介入。目前,包括CAR-T、双特异性抗体、纳米抗体、反义寡核苷酸(ASO)及重组多肽在内的创新疗法正处于密集的临床前开发阶段。这些疗法旨在解决大分子抗体入脑率低或单一靶向效果有限的痛点,例如通过双抗策略同时靶向TREM2与转铁蛋白受体(TfR)以实现“穿梭入脑”,或利用 CAR-T 技术重塑肿瘤微环境。虽然这些项目尚未进入临床试验,但其展示的精准调控潜力已成为该靶点竞争的“下半场”重心。
7、缔码生物TREM2产品助力药物研发
TREM2已从一个遗传学风险因子演变为一个切实可行的治疗靶点。但在如何实现精准的剂量控制以避免过度激活带来的副作用,及明确sTREM2与mTREM2在不同病理阶段的比例及意义等方面仍存在诸多挑战。缔码生物已开发出一系列TREM2靶点产品,包括全长TREM2蛋白、多种属TREM2胞外域重组蛋白、流式抗体与参照抗体,可用于免疫、抗体筛选及结合活性评估与细胞表面表达检测与亲和力分析。此外,缔码生物利用其创新型单B细胞抗体发现平台已成功筛选出多个TREM2抗体先导分子,欢迎各位咨询合作与测试。
| Product Type | Cat No. | Product Name |
| The full-length membrane protein | FLP100507 | Human TREM2 full length protein-synthetic nanodisc |
| ECD protein | PME100633 | Human TREM2 Protein, hFc Tag |
| PME-C100024 | Cynomolgus TREM2 Protein, hFc Tag | |
| PME-M100080 | Mouse TREM2 Protein, hFc Tag | |
| FC-validated mAb | DMC100223 | Anti-TREM2 antibody(DMC223); IgG1 Chimeric mAb |
| DMC100223P | PE-conjugated Anti-TREM2 antibody(DMC223); IgG1 Chimeric mAb | |
| DMC100223B | Biotinylated Anti-TREM2 antibody(DMC223); IgG1 Chimeric mAb | |
| BME100294 | Anti-TREM2(AL002 biosimilar) mAb | |
| BME100533B | Biotinylated Anti-TREM2(iluzanebart biosimilar) mAb | |
| BME100533 | Anti-TREM2(iluzanebart biosimilar) mAb |
Reference:
- Qiu H, Shao Z, Wen X, Jiang J, Ma Q, Wang Y, Huang L, Ding X, Zhang L. TREM2: Keeping Pace With Immune Checkpoint Inhibitors in Cancer Immunotherapy. Front Immunol. 2021 Sep 3;12:716710.
- Medd M. TREM2 in Regulating Macrophage Inflammatory Responses and Disease Pathogenesis. Crit Rev Immunol. 2025;45(2):15-24.
- Konishi H, Kiyama H. Microglial TREM2/DAP12 Signaling: A Double-Edged Sword in Neural Diseases. Front Cell Neurosci. 2018 Aug 6;12:206.


