在内分泌和自身免疫疾病研究领域,有一个靶点正在重回聚光灯下,那就是促甲状腺激素受体(TSHR, Thyrotropin Receptor)。近年来,围绕TSHR的治疗策略快速演进,从阻断性单克隆抗体、小分子拮抗剂到调控自身抗体的新机制,学术界与产业界均积极布局。临床研究显示,TSHR靶向抗体在Graves’病及甲状腺眼病中具备良好的安全性与初步疗效;同时,口服小分子拮抗剂和逆激动剂为长期治疗提供了新的可能。更重要的是,最新研究将TSHR的功能外延至代谢免疫调控和甲状腺癌领域,使其从“甲亢靶点”升级为跨越免疫、代谢与肿瘤的多维度治疗节点。
一、从结构到信号:TSHR如何精细调控甲状腺功能
TSHR是甲状腺功能调控网络中的核心分子,其独特的结构特征决定了对配体及自身抗体的高度敏感性,而其特异性的组织分布又使其在内分泌稳态与自身免疫性疾病中发挥关键作用。通过多通路耦联的信号转导机制,TSHR将外源性激素刺激或异常抗体信号转化为复杂的细胞功能响应,是连接结构、生理功能与疾病发生的重要枢纽。
1.1. TSHR结构特征:典型GPCR,却又不止于GPCR
TSHR(Thyroid-Stimulating Hormone Receptor)属于糖蛋白激素受体家族,是一类结构高度特化的G蛋白偶联受体(GPCR)。其由大型细胞外结构域(ECD)、典型七次跨膜结构域(7TM)及细胞内尾部组成,整体长度超过700个氨基酸,在GPCR中具有异常复杂的胞外结构。胞外区主要由富亮氨酸重复序列(LRRs)和铰链区构成,是TSH及刺激型(如M22)和抑制型抗体(如K1-70)的核心结合区域,并富含关键糖基化位点。跨膜区负责受体激活后的信号转导,与G蛋白及β-arrestin等效应分子相互作用。[1]
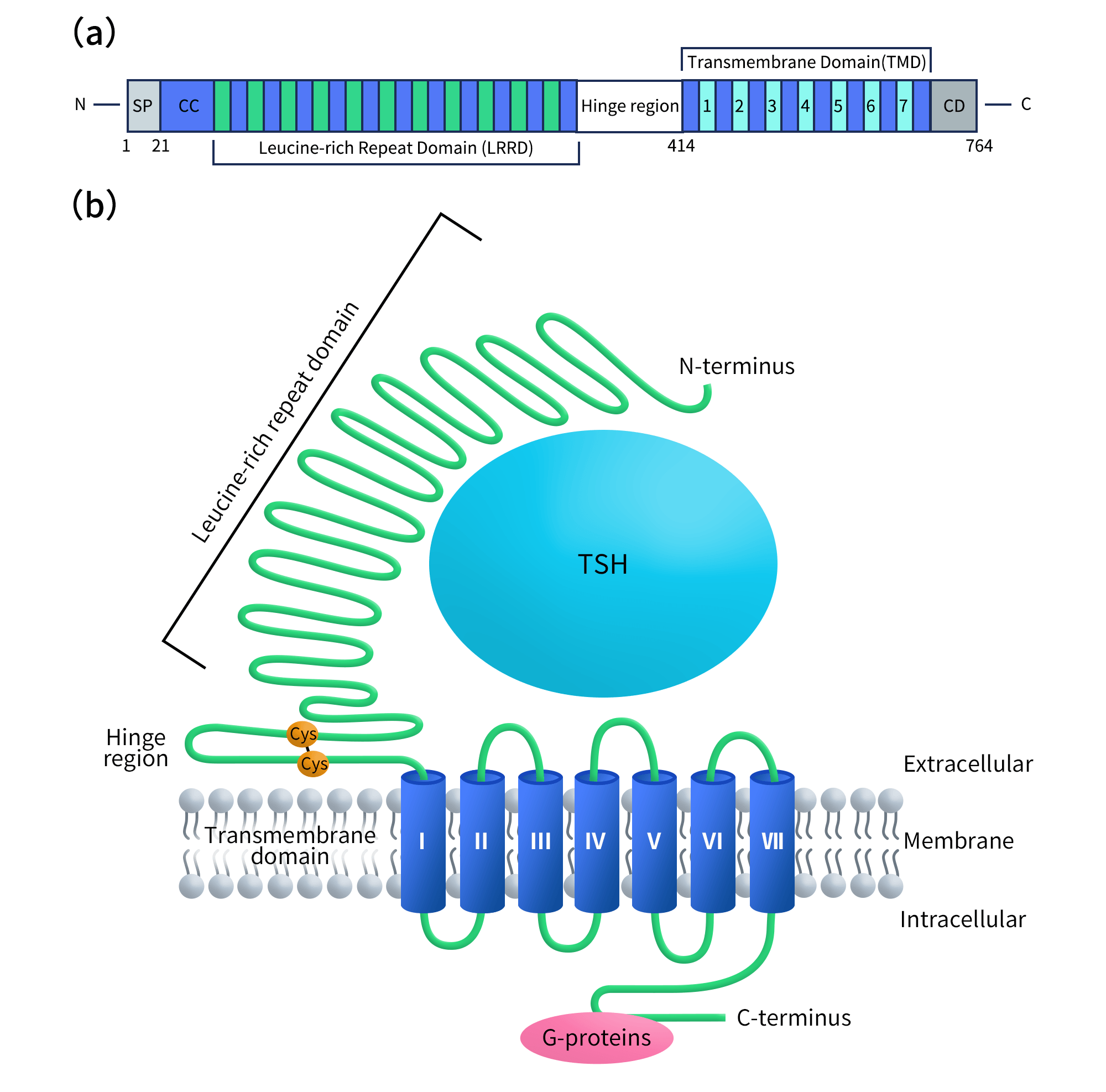
Figure 1. (a) Domain organization of the full-length TSHR protein. (b) The topology model of TSHR.
1.2. TSHR组织分布:从甲状腺走向全身多组织
TSHR传统上被认为主要表达于甲状腺滤泡细胞,是调控甲状腺激素合成与分泌的关键受体。但近年来研究发现,TSHR并非甲状腺特异性受体,而是在多种非甲状腺组织中同样存在表达。在Graves眼病患者中,TSHR可在眼眶成纤维细胞和脂肪细胞中检测到,其被刺激性抗体激活后可诱导脂肪增生、炎症反应及透明质酸沉积,导致典型眼眶病变。此外,TSHR也在免疫细胞(如巨噬细胞)中被发现,其信号可影响细胞代谢状态与炎症极化。部分甲状腺肿瘤,尤其是分化型及放射性碘难治型癌,仍保留TSHR表达,使其成为潜在的肿瘤治疗靶点。总体而言,TSHR的表达谱已显著拓展,为其在自身免疫病、炎症及肿瘤中的作用提供了分子基础。
1.3 TSHR功能与信号通路
TSHR具有高度多样化的信号功能,其核心信号网络涵盖经典激素调控、自身抗体介导的异常激活以及跨受体协同作用。最基础的机制是TSH结合TSHR后激活Gs-cAMP-PKA通路,促进甲状腺激素T3/T4的合成与分泌,这是维持正常甲状腺功能的核心信号轴[2],也是异常激活发生的生物学基础。
在自身免疫性甲状腺疾病中,TSHR的功能主要由不同类型抗体调控。刺激型抗体(如M22)结合胞外LRR区,诱导受体由非激活态向激活态构象转变,进而启动跨膜区信号传导[3];而阻断型抗体(如K1-70)通过竞争性结合抑制TSH或刺激型抗体作用,使受体维持非激活状态[4]。冷冻电镜研究表明,铰链区是这一构象切换的关键调控节点[5]。
结构层面上,TSHR激活态与胆固醇分子密切相关,提示其偏好定位于富胆固醇膜微区;同时,TM6外移、TM7内收等跨膜区构象重排是G蛋白耦联的关键步骤[5,6]。在Graves眼病中,TSHR还可与IGF-1R发生跨受体相互作用,放大炎症和脂肪生成信号,是疾病发生的重要分子基础[7,8]。此外,TSHR亦可通过β-arrestin及非经典通路调控透明质酸合成、细胞应激及炎症反应[2,9]。
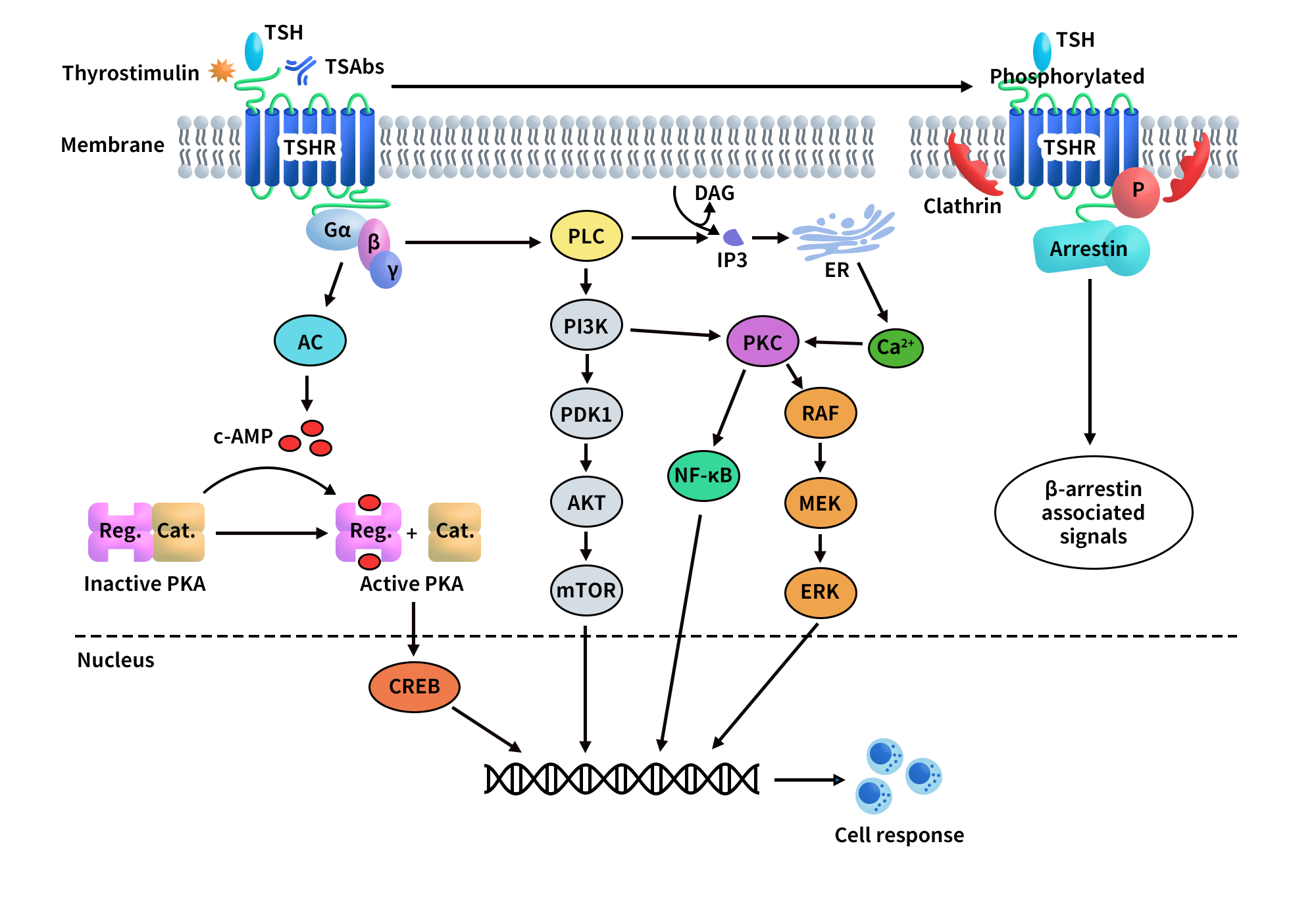
Figure 2. TSHR-mediated signaling pathways.
二、TSHR药物研发进展
TSHR是甲状腺功能调控的核心靶点,也是甲状腺相关疾病的重要治疗方向。近几年,围绕TSHR的药物研发明显加速,已经形成了“传统激动剂最成熟、小分子抑制剂最活跃、创新技术不断出现”的整体格局。目前已有2款激动剂药物正式上市,主要用于分化型甲状腺癌的诊断及治疗辅助。除此之外,还有多款临床在研药物,覆盖从Ⅰ期到Ⅱ期的不同阶段,其中Graves病和甲状腺相关眼病(TED)是开发最集中的领域。更值得关注的是,随着创新技术的发展,TSHR也开始被用于CAR-T细胞治疗、LYTAC降解剂、双靶点抗体、影像诊断探针等新型药物形式。这些探索主要面向更复杂或更难治的疾病,如难治性甲状腺癌、眼病等,展示了TSHR靶点未来的延展潜力。主要药物类型与代表性进展:
2.1 激动剂:临床最成熟的治疗方向
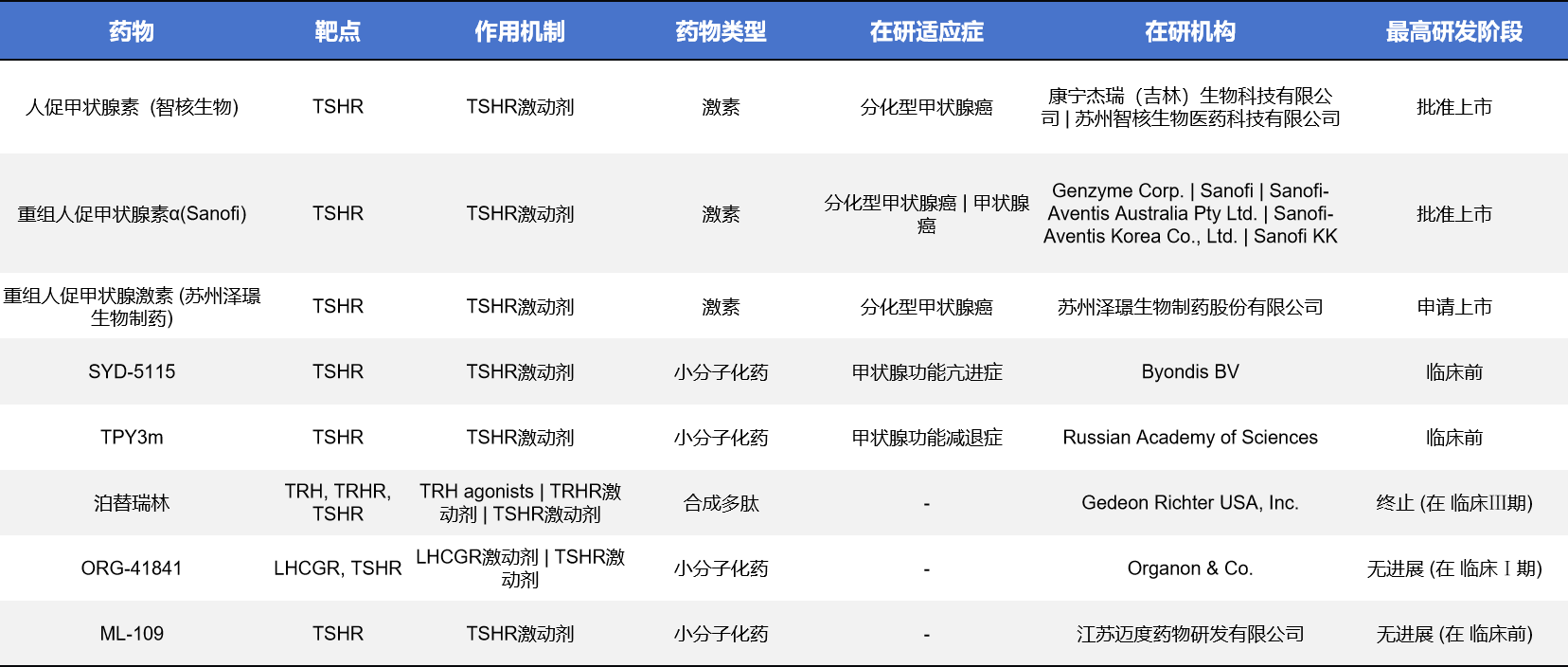
激动剂类药物是目前TSHR领域中最成熟、应用最广的类型。它们通过激活TSHR,提升甲状腺细胞对放射性碘的吸收,可以帮助医生更准确地进行分化型甲状腺癌的诊断和治疗决策。代表药物包括:人促甲状腺素(智核生物)、重组人促甲状腺素α(Sanofi)、泽璟生物的重组人促甲状腺激素等。其中前两款已经上市,并在临床使用多年,是当前TSHR靶点应用的基础。
2.2 小分子抑制剂:治疗Graves病的活跃赛道
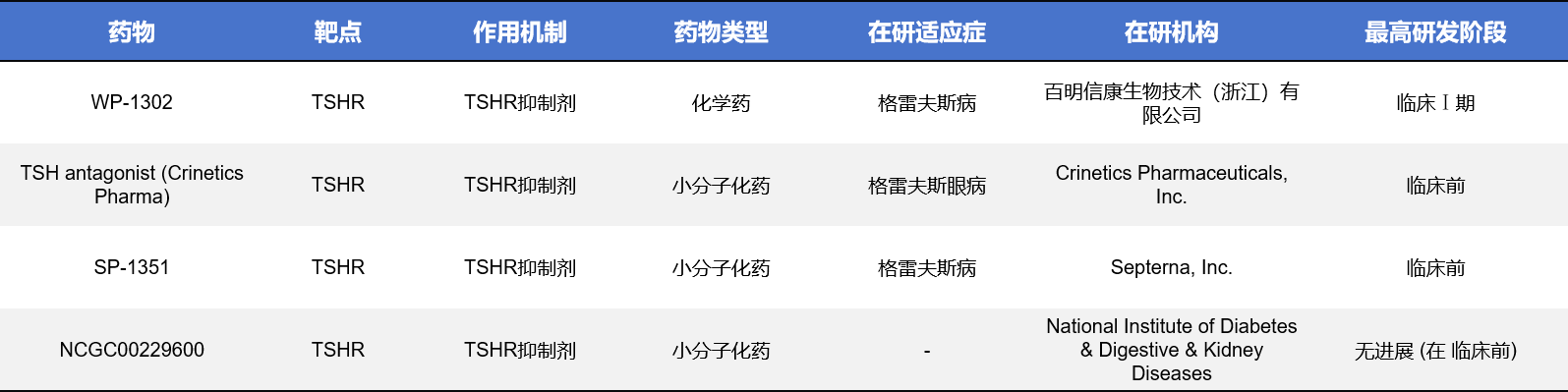
小分子药物正在成为TSHR靶点研发中最受到关注的方向,特别是在Graves病和眼病领域。这类药物通过阻断或调节TSHR的活性,减少异常免疫反应带来的甲状腺功能紊乱。
目前,多个药物进入临床或临床前阶段,例如:WP-1302(百明信康,临床Ⅰ期)、SP-1351(Septerna,临床前)、TSH antagonist(Crinetics,临床前)等。这些药物有望为Graves病患者提供比传统抗甲状腺药物更精准、更机制明确的治疗选择。
2.3 抗体及双特异性抗体:靶向信号通路的更精细调控
抗体类药物能够精准识别并干预TSHR的活化过程,是另一类发展迅速的治疗策略。例如:GenSci098(单抗)已进入临床Ⅰ期,VBS-102(TSHR+IGF1R双抗)正在进行临床前研究。其中双抗策略的出现,意味着可以同时调节两个与疾病密切相关的信号通路,为复杂性疾病(尤其是甲状腺相关眼病)提供更全面的干预方式。
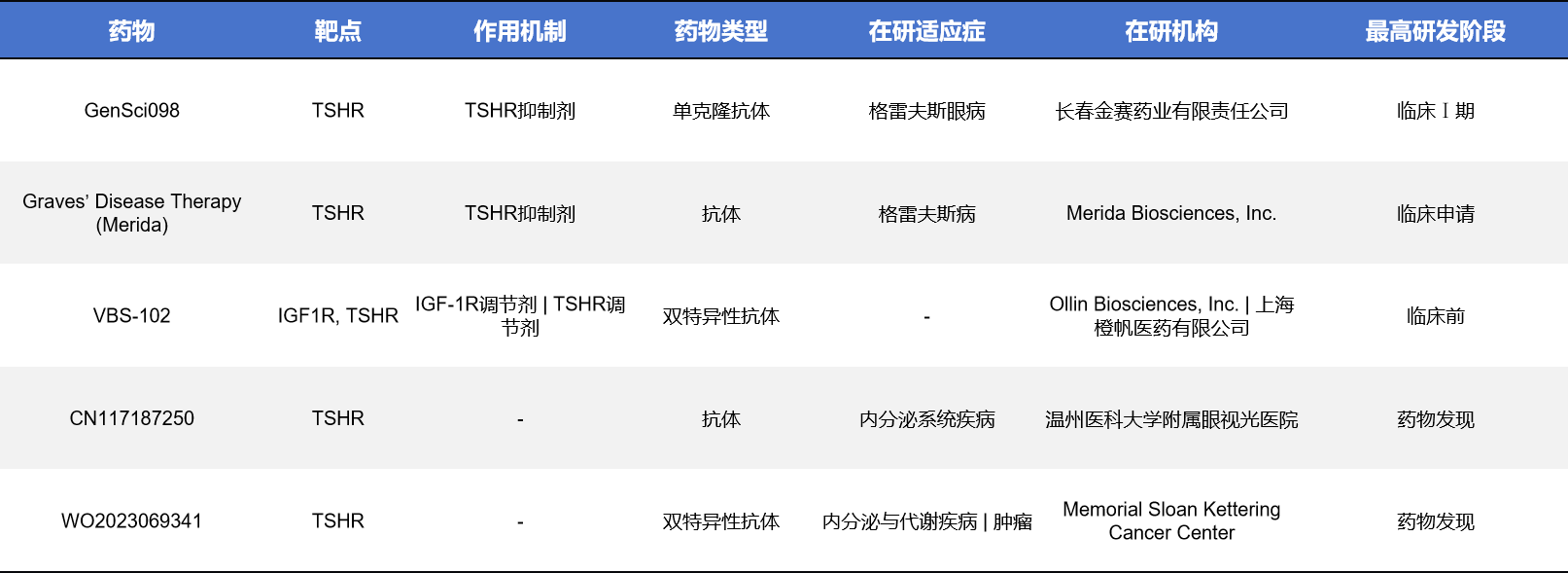
2.4 CAR-T治疗:面向甲状腺癌的前沿突破
TSHR在某些甲状腺肿瘤细胞上有较高表达,使其成为CAR-T细胞治疗的潜在靶点。目前已有多款TSHR-CAR-T进入临床或临床前阶段。例如:Anti-TSHR CAR-T(斯丹赛)已进入临床Ⅱ期,是TSHR在细胞治疗领域最领先的研发项目。其他院校如Martin Luther大学、徐州医科大学也在探索相关技术。这类疗法主要面向传统治疗效果有限的甲状腺癌,有望为患者提供全新的治疗选择。
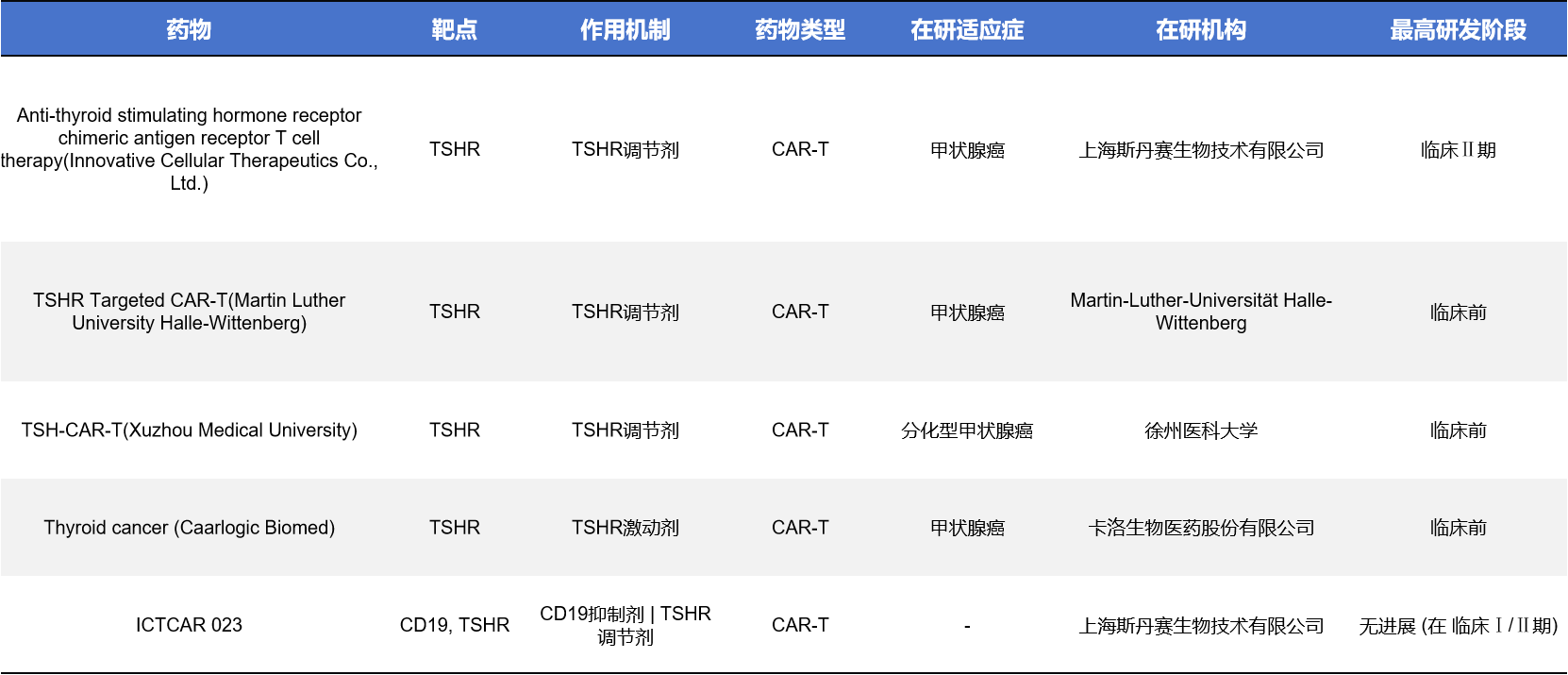
2.5 LYTAC降解剂:从源头减少受体数量的新机制
LYTAC(溶酶体靶向降解)是一类新兴的药物设计技术,可以直接“降解”细胞表面的靶点蛋白,而不仅仅是抑制其功能。LCA-0321(Lycia Therapeutics)是目前少数进入公开研发阶段的TSHR降解剂,用于探索治疗Graves病等受体过度活跃的疾病。这一方向在未来有望带来更强、更持久的疗效。

2.6 影像诊断探针:提升甲状腺癌的精准诊断
除治疗外,TSHR也被开发用于影像诊断。如89Zr-DFO-TSHR-Ab、TR1401/1402等放射性示踪分子,可用于PET成像,帮助医生识别甲状腺癌病灶,为手术或放射治疗提供更精细的指导。从激动剂到小分子、从抗体到CAR-T,再到LYTAC降解剂和影像诊断,TSHR的药物研发已从传统激素治疗扩展到多种前沿技术。随着不同药物类型不断创新,TSHR正逐渐成为覆盖诊断与治疗、传统与前沿并存的多维度靶点,未来在甲状腺疾病管理中将发挥更大的价值。

三、为什么TSHR是一个极具战略意义的靶点
综上所述,TSHR不仅仅是传统意义上的甲状腺功能调控受体,更是一个具有多重药物开发价值的全能靶点:
- 自身免疫性疾病:在Graves’病中,促甲状腺激素受体抗体(TSAb)是致病根源;针对TSHR的抗体或拮抗剂能直接中和或阻断其功能,是最为直接、机制清晰的治疗方式。
- 组织特异性病变:TSHR在眼眶(orbital fibroblasts)中表达,并参与Graves’眼病(GO)的病理重塑,因此针对该组织的抑制策略(如小分子、抗体)可以专门治疗GO。
- 代谢/免疫交叉:TSHR-CypD通路为代谢疾病(如胰岛素抵抗)提供新的分子机制,将TSHR从经典的甲状腺疾病靶点延展到免疫代谢疾病。
- 肿瘤:在甲状腺癌(尤其是放射性碘难治型)中,TSHR的表达和下游信号可能为治疗提供切入点;基于TSHR的CAR-T或靶向药物或成为未来方向。
- 结构基础扎实:得益于结构生物学的进展(如冷冻电镜解析TSH-TSHR-Gs复合体、M22抗体激活状态、K1-70抗体抑制状态等),我们对TSHR的激活/抑制状态有了深刻理解,为药物设计提供了坚实的结构依据。
- 安全性潜力:与传统甲状腺治疗(如抗甲状腺药物、放射性碘)相比,直接调控TSHR的策略可能副作用更具可控性。比如K1-70™在I期临床中表现出良好安全性。
因此,从临床需求、机制成熟度、结构基础到开发路径,TSHR都是一个非常具有前景、且多维度可开发的靶点。
四、缔码生物解决方案:全长TSHR-Nanodisc蛋白
在靶向TSHR的药物开发中,小分子、抗体与多肽等干预策略不断涌现,然而这些研究都高度依赖于具有完整构象与功能活性的受体蛋白。全长TSHR作为一种典型的GPCR,其跨膜结构复杂,传统表达体系难以在体外稳定维持其天然构象与信号转导能力,严重制约了配体结合、信号机制与药物筛选的研究进展。
因此,能在类膜环境中稳定呈现天然构象的全长TSHR nanodisc膜蛋白,已成为开展受体药理学、抗体识别与分子筛选的关键实验工具。缔码生物依托成熟的Nanodisc膜蛋白技术平台,成功制备了全长、具有完整跨膜结构与天然构象的TSHR蛋白。该蛋白在无去垢剂环境中保持稳定,可用于高效开展配体结合、信号机制、抗体表位分析与药物筛选等研究,为TSHR靶点研究提供更高的生物学相关性与数据可靠性。
Human TSHR full length protein-synthetic nanodisc(FLP120045)
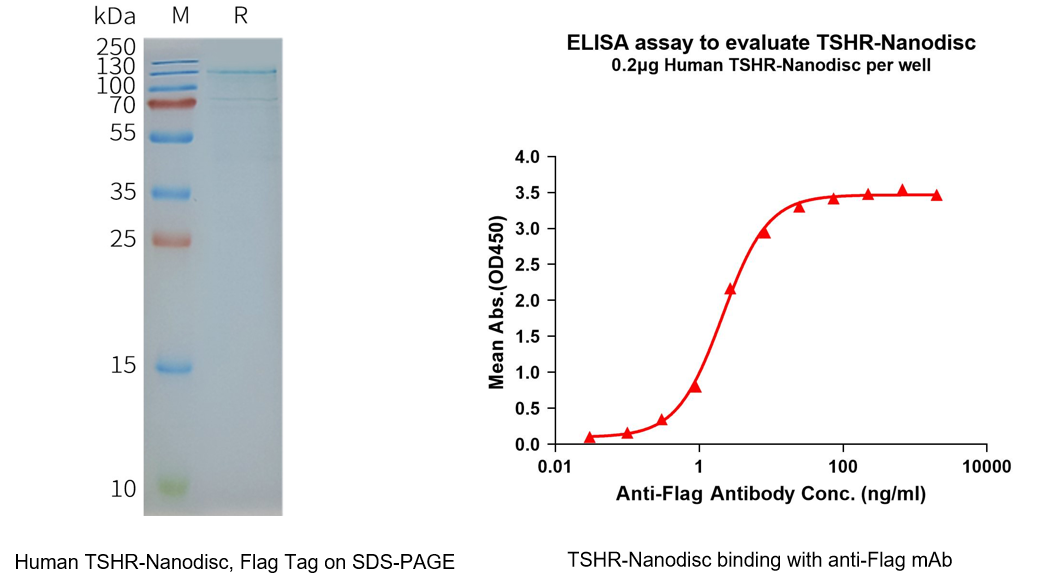
此外,我们还提供生物素标记定制服务,可满足基于链霉亲和素体系的多种检测、捕获与功能研究需求,支持药物筛选与机制研究的快速开展。
- TSHR靶点相关产品列表
|
Product Type |
Conjugate |
Cat.No. |
Product Name |
|
Recombinant Protein |
Unconjugated |
PME101523 |
|
|
Full Length Transmembrane Proteins |
Unconjugated |
FLP100045 |
|
|
Unconjugated |
FLP120045 |
||
|
Monoclonal antibodies |
Unconjugated |
DMC101228 |
|
|
Biotinylated |
DMC101228B |
||
|
Biosimilar reference antibodies |
Unconjugated |
BME100079 |
|
|
Unconjugated |
BME100080 |
||
|
Biotinylated |
BME100079B |
||
|
Biotinylated |
BME100080B |
||
|
PE-conjugated |
BME100079P |
||
|
PE-conjugated |
BME100080P |
- TSHR靶点先导分子进度

参考文献
- Zhang Y, et al. Targeting Thyroid-Stimulating Hormone Receptor: A Perspective on Small-Molecule Modulators and Their Therapeutic Potential. Journal of Medicinal Chemistry. 2024;67(18):16018-16034.
- Davies TF, et al. TSH receptor function and signaling: implications for Graves’ disease and thyroid eye disease. Endocrine Reviews / Autoimmunity reviews / Front Endocrinol.
- Sanders J, et al. Human monoclonal stimulating autoantibody M22 and its interaction with the TSH receptor. PNAS / J Biol Chem.
- Furmaniak J, et al. The blocking TSH receptor antibody K1-70 and its therapeutic potential. Clin Endocrinol / Thyroid.
- Jiang X, et al. Cryo-EM structure of the human TSH receptor in complex with stimulating autoantibody or ligand. Nature / Nature Communications.
- Kleinau G, et al. Comparative modelling and molecular dynamics of TSHR activation mechanisms. Autoimmunity Highlights.
- Krieger CC, et al. Structural and functional interaction of IGF-1R with TSHR in thyroid-associated ophthalmopathy. Endocrinology.
- Smith TJ, et al. Pathogenesis of thyroid eye disease: TSHR and IGF-1R crosstalk. Journal of Clinical Endocrinology & Metabolism.
- Morshed SA, et al. Non-stimulating TSH receptor antibodies induce cellular stress and inflammation. Thyroid / Endocrinology.


