2025年4月,一篇发表在NatureMedicine的临床个例报告令人振奋:一名因SCN2A(编码电压门控钠通道α亚基的基因)功能获得型(GoF)变异出现早发难治性癫痫的新生儿,接受鞘内注射elsunersen(一种靶向SCN2A的反义寡核苷酸ASO)治疗后,发作次数显著减少,神经功能也出现早期改善[1]。这一突破虽然只是单个病例,但意义非凡:它首次在人类层面证明,通过精准的基因表达调控,可以干预SCN2A相关疾病。同时,针对SCN2A的小分子药物在早期临床试验中也显示出积极信号[2],让“不可干预的遗传神经疾病”逐渐变得可治疗。
这些进展不仅给患者带来希望,也让科研与药物研发方向更加明确:理解SCN2A的分子机制、功能变化及其临床表现,是探索精准干预策略的关键。接下来,我们将从基因结构到作用机制,再到治疗策略,全盘梳理SCN2A研究与药物的最新进展。
1、SCN2A/NaV1.2结构
SCN2A,位于人类染色体2q24.3,是编码电压门控钠通道(voltage-gated sodium channel,VGSC)α亚基NaV1.2的基因。VGSC是神经系统中最关键的离子通道之一,其快速开放与关闭负责动作电位的启动和传播。NaV1.2由四个重复结构域(DI–DIV)组成,每个结构域包含六个跨膜螺旋(S1–S6),S4螺旋为电压感受器(Voltage sensor),S5–S6及其环结构形成通道孔,其中DEKA氨基酸形成离子选择性滤过器,决定钠离子的通透性与选择性[3]。重复结构III与IV之间的胞质环是快速失活门(Fast inactivation gate)。目前NaV1.2已知存在两种亚型,它们在第209位氨基酸上有一个差异。该通道可与AnkyrinG(ANK3)结合,将其固定在膜上,并与钙调蛋白相互作用。在无义介导降解边界之前的终止密码子可预测阻止蛋白翻译,而边界之后的终止密码子可能不会阻止翻译。NaV1.2在静息时关闭。充分的正向膜电压可使通道打开,允许钠离子流动,随后通道被快速失活门阻断。当膜电位恢复静息状态时,通道重置。
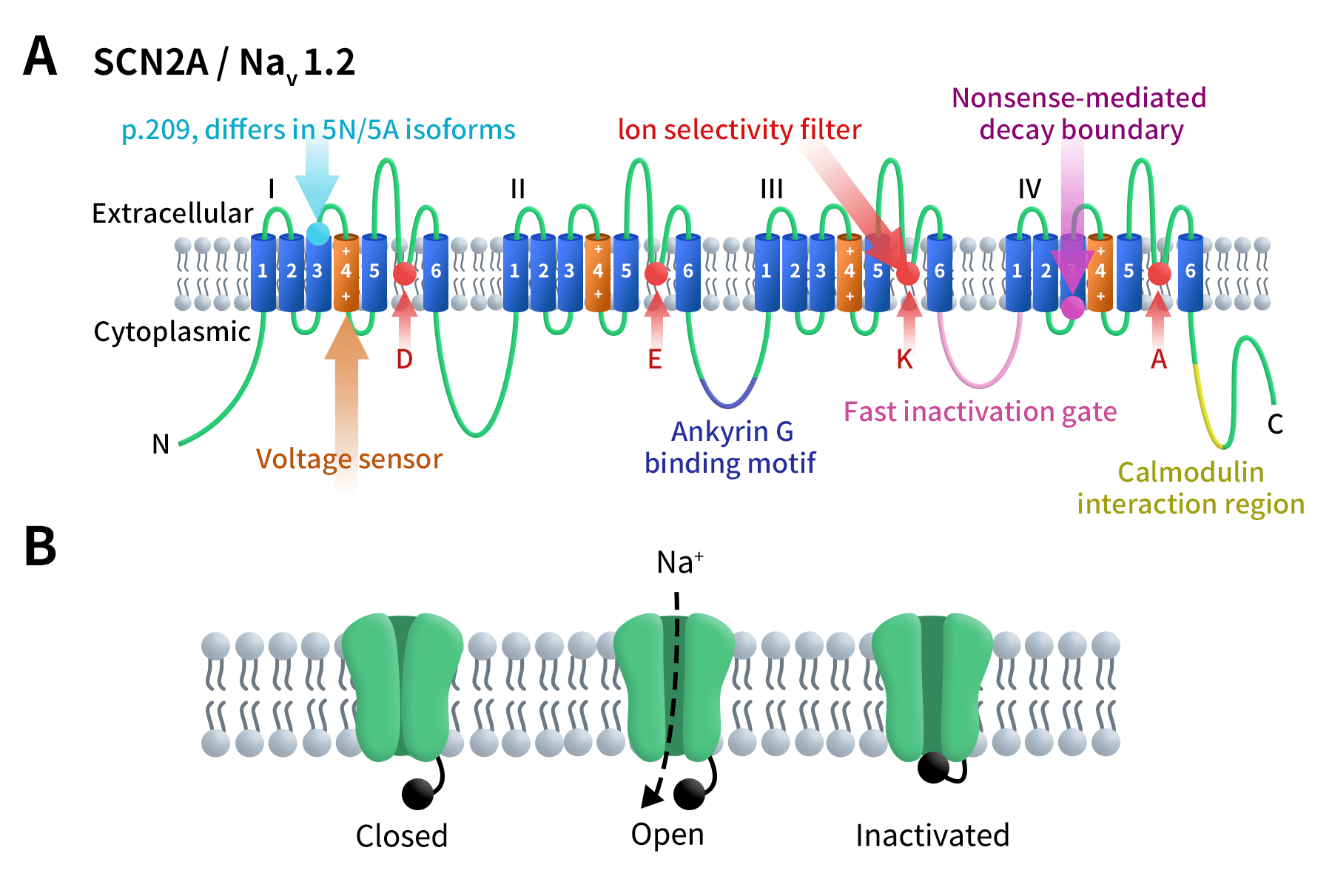
Figure1.The structure of SCN2A/NaV1.1 [4]
2、钠通道家族与SCN2A/NaV1.2
如前所述,电压门控钠通道(Voltage-Gated Sodium Channels, NaV)是神经系统兴奋性信号传导的核心蛋白,它由α亚基和辅助β亚基组成。人类NaVα亚基由SCN1A–SCN11A(NaV1.1-NaV1.9)编码,不同成员在中枢和外周神经系统分布不同,并在神经发育、动作电位触发以及神经网络活动中发挥独特功能[3]。其中NaV1.1、NaV1.2、NaV1.3和NaV1.6与中枢神经系统发育及癫痫密切相关。
在中枢神经系统,NaV1.1(SCN1A)主要表达于抑制性神经元,调节抑制信号;而NaV1.2(SCN2A)主要分布于兴奋性神经元的轴突初段(AIS)和树突区,负责动作电位触发和神经信号传递[5]。NaV1.6(SCN8A)在发育成熟后逐渐取代部分NaV1.2功能,但NaV1.2在树突和未髓鞘化轴突中的表达仍不可替代。SCN2A的这种时空特异性解释了其变异在不同发育阶段可能导致癫痫、自闭症或认知障碍等不同临床表现[5]。
3、SCN2A/NaV1.2作用机制
NaV1.2是电压门控钠通道的亚单位,是中枢神经系统中兴奋性神经元的重要通道。NaV1.2在轴突初段(axon initial segment, AIS)及树突中高度表达,对动作电位的产生与传播起关键作用。正常情况下,NaV1.2通过快速激活和失活调控钠离子流入,使神经元能在恰当的时间产生动作电位,并维持神经网络的稳定兴奋性。当SCN2A基因出现致病性变异时,就可能引起NaV1.2通道功能异常,从而干扰神经元放电、突触传递与神经回路发育。
功能学研究显示,SCN2A变异可以分为功能获得(gain-of-function, GOF)和功能丧失(loss-of-function, LOF)两大类型,这是两类截然不同的功能效应。GOF型变异使NaV1.2通道更易激活或难以失活,从而导致神经元过度兴奋,常见于新生儿或婴儿期癫痫。相反,LOF型变异一般降低通道表达或减少钠电流密度,导致神经元兴奋性减弱,这与智力障碍(ID)、自闭症(ASD)等无癫痫表现的神经发育异常更为相关[6]。
不过,现实情况远比“GOF→癫痫、LOF→ASD/ID”更复杂。最新的人源iPSC神经元模型研究显示,即使是ID患者所携带的SCN2A变异,也可能表现为混合或不对称的功能缺陷:一些变异导致NaV1.2蛋白水平显著下降(可能因为被细胞提前降解,或本身不稳定),使神经元钠电流密度和动作电位发放明显减少[7]。
此外,有研究还将某些SCN2A变异与大脑皮层发育异常(如皮层发育不良,MCD)联系起来,这提示SCN2A的致病机制不仅是离子通道功能改变,还可能通过干扰神经发育过程,影响皮层结构与网络连接[8]。
4、SCN2A/NaV1.2药物研究进展
SCN2A的致病机制是多层面的:通道生物物理特性改变(如激活/失活门控改变)、通道表达量或稳定性下降、神经元发育与回路组建异常,以及更复杂的基因-环境与发育时序交互作用——这些机制综合决定了最终的临床表型:从新生儿癫痫、发育性癫痫性脑病,到仅表现为ASD/智力发育障碍等。目前针对SCN2A相关疾病的治疗策略快速分化为三大路线:一类是精准小分子,旨在调节钠通道活性以纠正GOF/异常激活;一类是反义核酸(ASO)/个体化寡核苷酸,旨在减少致病等位基因表达(主要用于GOF),或恢复表达(针对LOF的基因上调策略仍在早期探索);还有一类是基因治疗/AAV/基因编辑方向,以恢复或替代缺陷功能为目标(多为临床前或早期开发)。
这些策略的临床与临床前证据正在累积,部分药物已经进入多国临床试验或获得监管优惠。
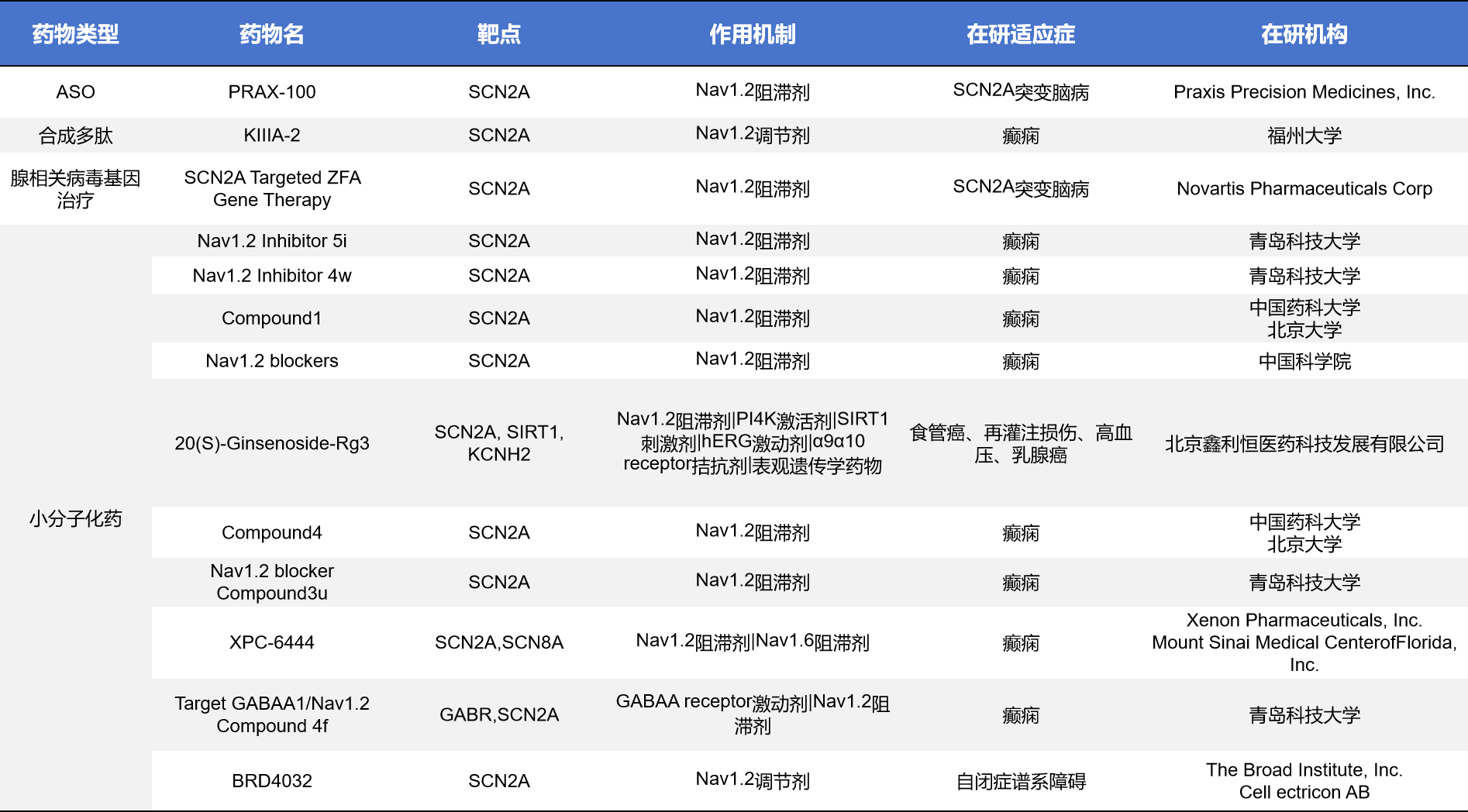
不完全统计,目前全球靶向SCN2A的药物共计有26款,其中有13款处于临床前,处于终止或无进展状态的共计有9款,当前处于活跃临床阶段的药物只有4款。
- 小分子化合物
Tetrodotoxin(TTX)是一类高选择性电压门控钠通道(NaV)阻断剂,可靶向SCN1A、SCN2A、和SCN5A三个靶点,由WEX Pharmaceuticals开发。该药可快速抑制神经元动作电位的产生,主要用于镇痛与神经性疼痛治疗方向。其关键候选药物Halneuron(TTX注射剂)已进入III期临床试验,用于癌痛、化疗诱导性神经病变(CINP)等多种慢性顽固性疼痛。Halneuron已获得FDA快速通道资格,公司也与中国合作方完成区域授权交易。作为非阿片类镇痛新机制药物,TTX仍处于后期临床验证阶段,尚未获批上市。
NBI-355是由Neurocrine Biosciences开发的一款小分子钠通道阻断剂,靶向Nav1.2/Nav1.6(即SCN2A/SCN8A所编码的钠通道亚型),用于治疗癫痫。它的作用机制是阻断过度活跃的钠通道,从而减少神经元的病理性放电。NBI-355目前处于Ⅰ期临床试验阶段。
- 反义核酸
Elsunersen,又名PRAX-222,是由Praxis Precision Medicines(与Ionis Pharmaceuticals / RogCon, Inc.合作)开发的一款反义寡核苷酸(ASO),其作用机理是选择性靶向并降低SCN2A的mRNA表达,从而减少NaV1.2钠通道生成,矫正因SCN2A GOF导致的钠流过度与神经元过度兴奋。当前,Elsunersen已进入针对早发型SCN2A-DEE的III期注册性临床试验,并已获得美国FDA的孤儿药ODD与稀有儿科疾病(RPD)认定,以及European Medicines Agency (EMA)的PRIME优先医学资格。
nL-SCN2A-002是由n-Lorem Foundation推出的个体化反义寡核苷酸(ASO),通过等位基因选择性诱导R NaseH降解突变型SCN2A转录本,旨在减少致病性NaV1.2表达并缓解GOF型癫痫。该候选药以N-of-1、经蛛网膜下腔(IT)给药的I/II研究推进(临床登记NCT06314490),已有早期个案报告显示安全性良好并出现发作频率下降的初步信号。当前仍处于早期临床/研究者发起试验阶段。
此外,还有部分处于临床前的药物,药物类型包括小分子化合物、合成多肽及腺相关病毒基因治疗等。
5、缔码生物SCN2A nanodisc全长膜蛋白助力Nav1.2靶向药物研发
尽管目前针对SCN2A的药物开发已出现ASO、小分子等多种策略,但所有机制研究与药物筛选都离不开高质量的NaV1.2膜蛋白。全长度电压门控钠通道结构复杂、跨膜区众多,传统可溶片段或细胞膜粗提物难以满足结构解析、结合位点验证及药筛需求。因此,能稳定呈现天然构象的SCN2A nanodisc全长膜蛋白,正成为开展机理研究与先导化合物评估的关键工具。
缔码生物利用其哺乳动物细胞表达系统已成功制备了具有天然构象与完整跨膜结构的全长 SCN2A(NaV1.2),该蛋白可在无去垢剂环境中保持天然构象与翻译后修饰,为结构分析、抗体筛选与药物结合测试提供更可靠的靶点模型,正逐渐成为药物研发早期的重要资源。
Human SCN2A full length protein-synthetic nanodisc (FLP100723)
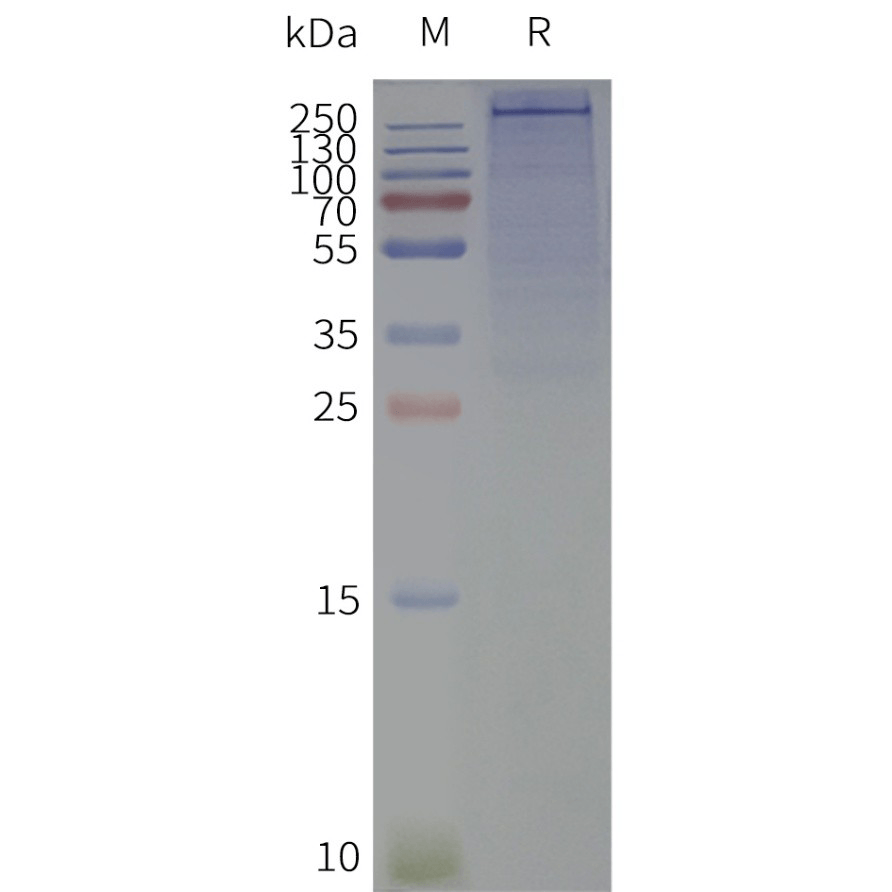
Human SCN2A-Nanodisc, Flag Tag on SDS-PAGE
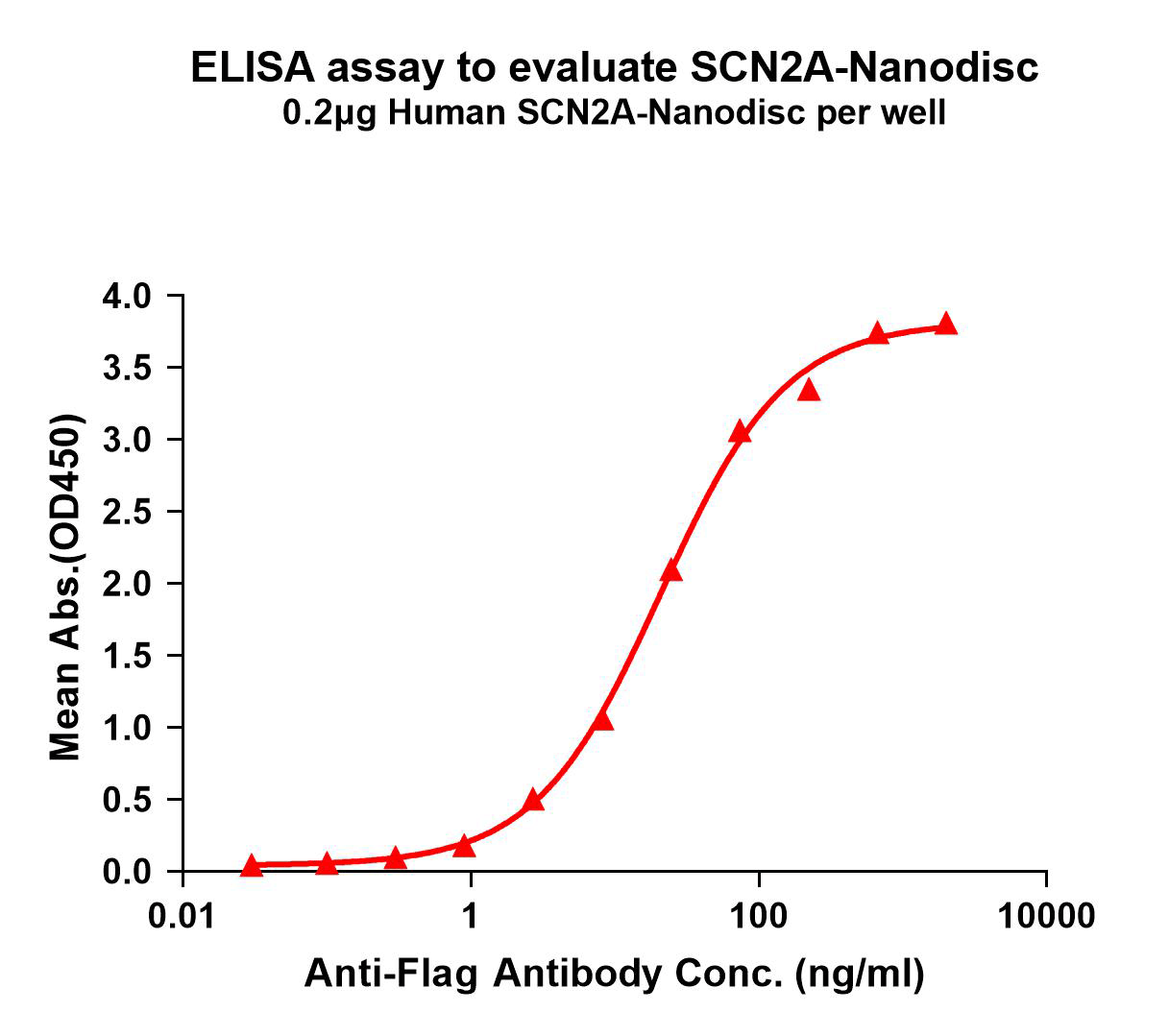
SCN2A-Nanodisc binding with anti-Flag mAb
此外,作为专业膜蛋白生产厂家,缔码生物还可提供其同家族蛋白供您做交叉筛选。
|
靶点 |
货号 |
产品名称 |
|
SCN3A/Nav1.3 |
FLP120724 |
|
|
SCN4A/Nav1.4 |
FLP120725 |
|
|
SCN5A/Nav1.5 |
FLP100726 |
|
|
SCN8A/Nav1.6 |
FLP120727 |
Human SCN8A-Strep full length protein-synthetic nanodisc IN STOCK |
|
SCN9A/Nav1.7 |
FLP120728 |
参考文献


