2023年……
5月12日,礼新医药宣布将GPRC5D ADC新药LM-305项目的全球权益授权给阿斯利康。根据协议条款,礼新医药可获得的5500万美元近期付款和最高达5.45亿美元的里程碑付款,以及基于全球年度净销售额分成;5月19日,原启生物研发的OriCAR-017临床试验申请已获得受理,这是国内首款靶向GPRC5D的CAR-T细胞治疗产品。6月8日-11日,Janssen在的欧洲血液学会(EHA)会议上公布了一项Talquetamab临床II期关键结果,曾接受过中位三线及以上疗法的复发或难治性发性骨髓瘤患者,在接受每周0.4 mg/kg与每两周0.8 mg/kg的talquetamab皮下注射治疗后,12个月存活率分别达76.4%和77.4%。Talquetamab是一款GPRC5D双抗,GlobalData估计它最早将于2024年在美国上市。GPRC5D靶向药动态的不断更新,再次将GPRC5D靶点拉回到行业热点。那GPRC5D究竟有何魔力让阿斯利康如此大手笔呢?国内外又有哪些药企布局了这个靶点?
1、GPRC5D是什么?
GPRC5D是GPRC5受体家族中的一员,属于G蛋白偶联受体C家族中的孤儿受体类,配体及信号传导机制尚未确定。GPRC5A在肺中高水平表达[1],GPRC5B的表达主要集中在神经元中,但在其他组织中也有表达[2]。GPRC5C表达更为广泛,在肾、肝、小脑等组织中表达量较高[3]。GPRC5D仅表达于有免疫赦免性的毛囊区域[4],但在原代多发性骨髓瘤(MM)细胞表面高表达 [5]。人和小鼠的GPRC5D分别由300个和345个氨基酸组成。与其他GPCR受体一致,GPRC5D是七次跨膜蛋白,有四段胞外结构。不同的是,GPRC5D第一段胞外区最长,有27个氨基酸,第三段胞外区结构含23个氨基酸,第二个和第四个胞外区较短,分别由9个氨基酸和14个氨基酸组成。
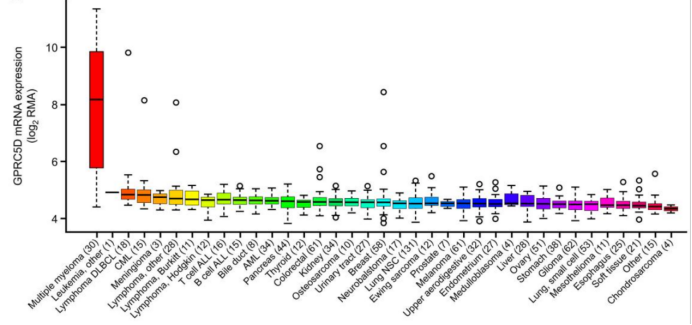
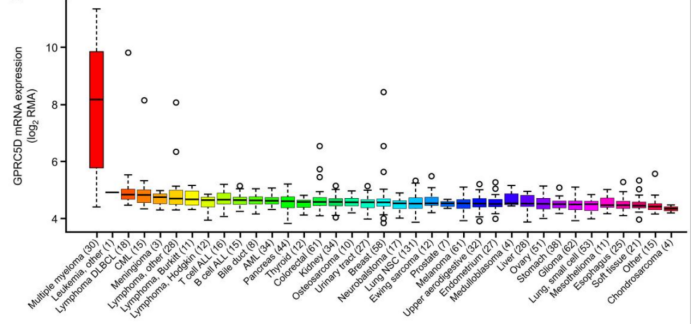
Figure1 mRNA expression of GPRC5D in malignant cell lines
(源 Smith EL et al., Sci Transl Med. 2019)
2、GPRC5D与多发性骨髓瘤
多发性骨髓瘤(MM)是全球第二常见的血液学癌症。治疗MM的传统方法包括使用免疫调节剂、蛋白酶体抑制剂和抗cd38抗体。然而,这些治疗方法对MM患者疗效比较有限,而且总体预后通常较差。随着双特异性抗体和嵌合抗原受体(CAR-T)细胞疗法的飞速发展,多发性骨髓瘤的治疗取得了很大的进展,但是它仍被认为是无法治愈。在GPRC5D之前,业内认为靶向BCMA的CAR-T细胞疗法是最有希望的。尽管BCMA在大多数恶性浆细胞上表达,但表达存在异质性,可能导致不同的反应 [6]。而且,由于γ分泌酶介导的细胞外结构域脱落,细胞表面BCMA的表达随时间而变化。对于BCMA阴性或BCMA低表达的MM病患来说,在接受靶向BCMA CAR T-细胞治疗后仍会复发,存在靶向逃逸问题。为缓解BCMA逃逸介导的复发问题,寻找更好的特异性MM靶点(如GPRC5D)或同时靶向其他抗原靶点(如CD3、CD19、CD38、GPRC5D等)是关键。与BCMA相比,GPRC5D具有更好的特异性,而且其表达不会随着时间减少,同时两者表达独立,既可单靶向也可以双靶向开发治疗药物。那目前国内外有哪些药企布局了GPRC5D管线?进展又如何?
3.GPRC5D靶向药在多发性骨髓瘤适应症中的管线汇总
据不完全统计,目前已上临床的GPRC5D管线共计7项,其中phase 1有5项,Phase 2有1项,Phase 3有1项,大部分以双抗和CAR-T疗法为主。
- Talquetamab
Talquetamab是由强生研发的GPRC5D x CD3双特异性抗体,在众多GPRC5D靶向药中Talquetamab遥遥领先。GPRC5D是表达在多发性骨髓瘤细胞上的靶标,其表达不会随着时间而减少,而CD3则是T细胞受体,与活化T细胞有关。当前最高研究阶段为Phase 3。
2022年12月,强生向FDA提交了上市的BLA申请,用于治疗复发或难治性多发性骨髓瘤。此前,该药已获得欧洲药品管理局授予的优先药品资格,以及FDA授予的孤儿药资格与突破性疗法认定还有CDE授予的突破性疗法。
2023年1月强生启动一项国际多中心的3期临床研究,以评估talquetamab(皮下注射)联合其它药物在复发性或难治性多发性骨髓瘤患者中的疗效和安全性。
2023年3月31日,中国国家药监局药品审评中心(CDE)官网公示,强生申报的talquetamab注射液拟被纳入突破性治疗品种,针对适应症为:治疗接受过至少3种既往治疗的复发或难治性多发性骨髓瘤(RRMM)成人患者。
- OriC-321和OriCAR-017
OriC-321和OriCAR-017是原启生物针对适应症MM的两款GPRC5D CAR-T产品。原启生物利用其专有的CAR-T技术平台,构建了独特信号激活域元件Ori。该原件插入Next Generation CAR结构后,能成倍提升记忆性免疫细胞的扩增效率,有效突破TME中的细胞外基质的物理屏障,显著增强CAR-T在体内的抗肿瘤活性和持久性,具有更好的防止复发潜力。
OriC-321由是原启生物与浙江大学合作开发,同时靶向BCMA和GPRC5D,当前还处于临床前的概念验证(POC)阶段。
OriCAR-017是原启生物开发的另一款靶向GPRD5D的嵌合抗原受体T细胞治疗,用于治疗复发/难治性多发性骨髓瘤(R/R MM),当前最高的研究阶段Phase1。
2022年6月,原启生物在2022ASCO年会上口头报告了临床I期POLARIS临床试验数据。截止2022年04月30日,所有可评估数据显示ORR 100%,MRD阴性率100%(28天评估),包括既往BCMA CAR-T治疗失败的受试者在内的所有受试者。2023年1月,该项临床研究数据在《Lancet Haematology》上发表。
2022年10月,OriCAR-017获美国FDA授予“孤儿药”资格,用于治疗复发难治性多发性骨髓瘤。
- MCARH109
MCARH109是由纪念斯隆凯瑟琳中心(MSKCC)与优瑞科(Eureka Therapeutics)联合研发的另一款GPRC5D CAR-T产品。在体外研究中,MCARH109展现了良好的疗效,同时其也在BCMA耐药模型展现了较好的活性。当前最高研究阶段Phase 1。该项Ⅰ期剂量扩增研究入组多线治疗失败的MM患者(包括接受BCMA CAR T细胞治疗后复发的患者),给予4个剂量水平的MCARH109治疗。
- RG6234
RG6234(Forimtamig,GPRC5DxCD3)是罗氏研发的一款GPRC5D的T细胞衔接双特异性抗体,包含两个与靶点结合的蛋白域和一个与CD3结合的蛋白域。罗氏表示,这款双特异性抗体具有“best-in-class”潜力。在治疗多发性骨髓瘤患者的早期临床试验中,ORR超过71%,CR超过35%。
- CAR-GPRC5D
CAR-GPRC5D是由上海雅科生物研发的GPRC5D CAR-T细胞疗法,近期在与徐州医科大学联合开展的II期临床试验中获得可喜结果。该研究采用国际领先的GPRC5D CAR-T细胞治疗技术,成功治疗了33例复发难治性多发性骨髓瘤患者,并获得ORR达91%的优异疗效。其中,在既往接受过 BCMA CAR-T细胞治疗的9例患者中,ORR为100% [7]。
- LM-305
LM-305是一种新型的靶向GPRC5D抗体偶联药物(ADC),由一个抗GPRC5D单克隆抗体、一个可降解的蛋白酶连接子和一个细胞毒素载荷单甲基奥瑞他汀E(MMAE)组成。它是礼新医药基于独家ADC平台自主研发的第二款产品。近期,礼新医药已授权阿斯利康LM-305全球开发和商业化权益并达成独家许可。
LM-305是全球首款进入临床阶段的GPRC5D-ADC。早在去年7月,FDA已批准LM-305在美国开展临床,计划开展一项开放标签、多中心I/II期临床研究,旨在评估其在多发性骨髓瘤患者中的安全性、耐受性、药代动力学和初步抗肿瘤活性。
4、缔码生物GPRC5D蛋白抗体,助力GPRC5D药物研发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。公司拥有完善的多穿膜蛋白制备平台Nanodisc、独特的先导抗体分子序列库、创新的抗体人源化平台和成熟的CAR T体外/体内功能分析验证平台,旨在让药企跨过单抗平台建立和先导分子筛选的门槛,有更多的时间聚焦于药靶的生物学机制和可成药性研究,从而更快地推进临床管线。
正如前面所提到的,目前已上临床的GPRC5D管线共计7项,其中CAR-T有4项,双抗有2项,ADC有1项。缔码生物GPRC5D治疗性抗体开发部分应用数据如下:
- FACS评估缔码不同人源化Anti-GPRC5D scFv(G01~G09)与MARCH109(G00)亲和力
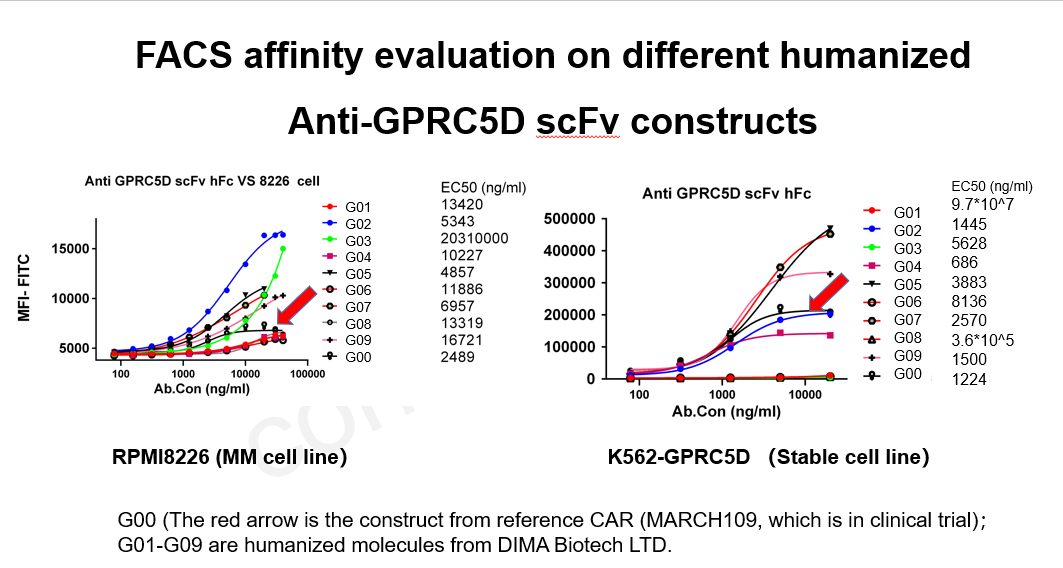
Figure 2. Affinity ranking of 9 humanized anti-GPRC5D DIMA’s mAbs through flow assay. Comparing to BMK antibody (G00) pointed by red arrow, derived from a CAR construct currently in phase I clinical trial, 4 out of 9 DIMA’s mAbs exhibit stronger binding affinity on both RPMI8226 or K562-GPRC5D stable cell line.
- GPRC5D CAR-T体外杀伤试验

Figure 3. In vitro tumor cell cytotoxicity assay. The experimental data showed that several of CARs constructed from DIMA’s mAbs exhibit stronger cytotoxic capacity than bench-mark CAR (G00), pointed by red arrows, especially under low Effector:Tumor ratio.
- GPRC5D CAR-T治疗后小鼠生存曲线
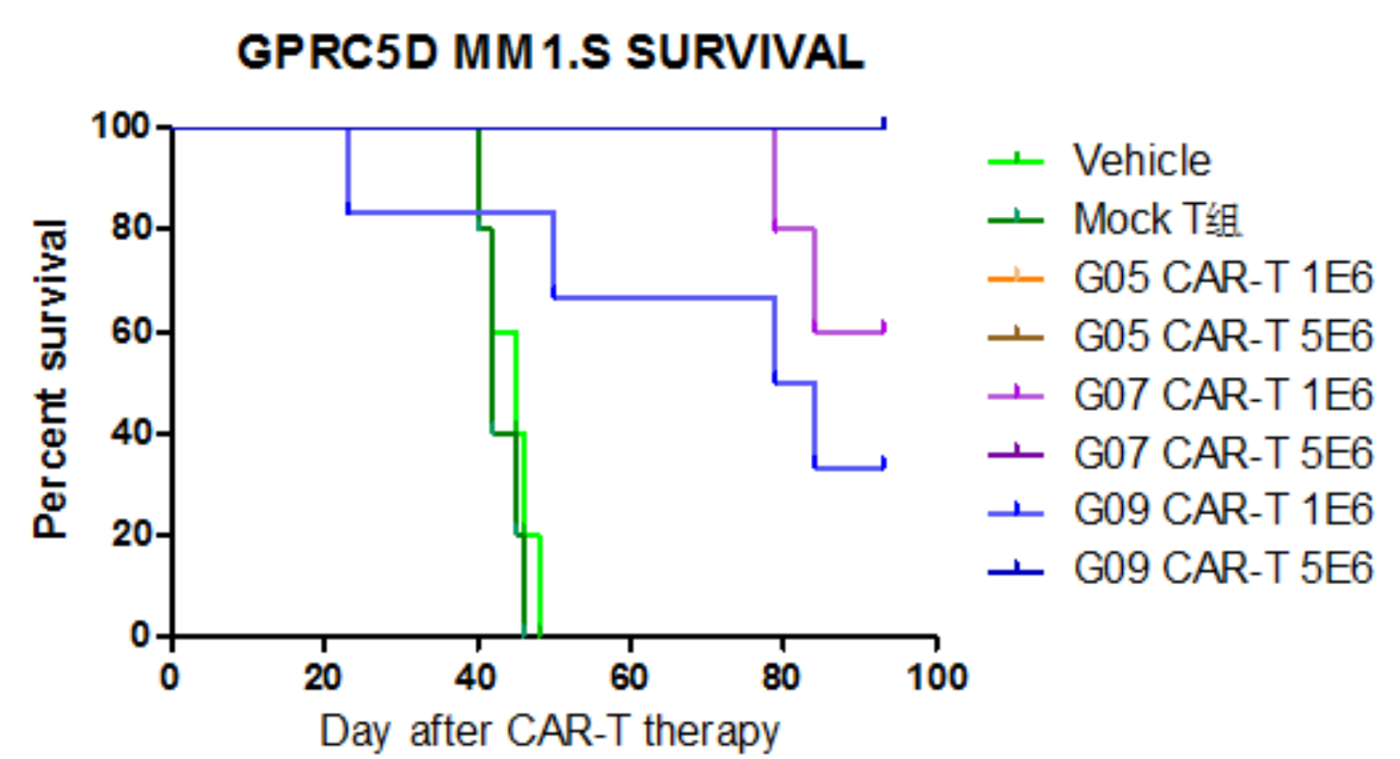
Figure 4. Animal survival data. Multiple myeloma (MM) model mice infused with two dosage of CAR T-cells exhibit elongated survival time comparing with control groups.
- 缔码所有GPRC5D产品
参考文献:
[1] Sporn MB. A new tumor suppressor gene, selective for lung cancer. J Natl Cancer Inst. 2007;11:1654–1655.
[2] Tao Q, Cheng Y, Clifford J, et al. Characterization of the murine orphan G-protein-coupled receptor gene Rai3 and its regulation by retinoic acid. Genomics. 2004;11:270–280.
[3] Xu J, Tian J, Shapiro SD. Normal lung development in RAIG1-deficient mice despite unique lung epithelium-specific expression. Am J Respir Cell Mol Biol. 2005;11:381–387.
[4] Brauner-Osborne H, Krogsgaard-Larsen P. Sequence and expression pattern of a novel human orphan G-protein-coupled receptor, GPRC5B, a family C receptor with a short amino-terminal domain. Genomics. 2000;11:121–128.
[5] Smith EL, Harrington K, et al. GPRC5D is a target for the immunotherapy of multiple myeloma with rationally designed CAR T cells. Sci Transl Med. 2019 Mar 27;11(485):eaau7746.
[6] Brudno JN, Maric I, Hartman SD, et al. T Cells Genetically Modified to Express an Anti-B-Cell Maturation Antigen Chimeric Antigen Receptor Cause Remissions of Poor-Prognosis Relapsed Multiple Myeloma. J Clin Oncol. 2018 Aug 1;36(22):2267-2280.
[7] Xia J, Li H, Yan Z, et al. Anti-G Protein-Coupled Receptor, Class C Group 5 Member D Chimeric Antigen Receptor T Cells in Patients With Relapsed or Refractory Multiple Myeloma: A Single-Arm, Phase Ⅱ Trial. J Clin Oncol. 2023 May 10;41(14):2583-2593.