近年来,两个新药的接连获批使一个趋化因子受体靶点再次引发关注:2023年,FDA批准Motixafortide(商品名Aphexda)联合长效G-CSF用于多发性骨髓瘤患者的造血干细胞动员;2024年,FDA又批准Mavorixafor(Xolremdi)用于治疗WHIM综合征——一种罕见的免疫缺陷病。这两种作用机制迥异的药物,瞄准的却是同一个受体:CXCR4。这并非偶然,而是源于CXCR4在造血、免疫、肿瘤转移等多个生理与病理过程中的核心调控地位。接下来,我们一起深入了解这一靶点本身及其相关药物的研发进展。
1. CXCR4概述
1.1 CXCR4结构
趋化因子受体是一个包含多个成员的大家族,主要介导细胞沿趋化因子梯度的趋化运动。其中,CXC趋化因子受体4(CXCR4)是一种位于2号染色体上的G蛋白偶联趋化因子受体。CXCR4属于视紫红质样(rhodopsin-like)家族,含有352个氨基酸。其结构包括一个胞外的N端结构域、7个跨膜螺旋、三个胞外环、三个胞内环以及一个胞内C末端结构域。该受体在质膜中可呈多种聚合状态,包括单体、二聚体、高阶寡聚体甚至纳米簇(nanoclusters)。已有晶体结构研究显示,CXCR4可通过TM5和TM6螺旋区域的相互作用形成稳定的同源二聚体,其中TM6还可能参与纳米簇的形成。此外,CXCR4还能与近缘的非典型趋化因子受体ACKR3(CXCR7)形成异源二聚体,赋予其独特的配体识别与信号调控功能。
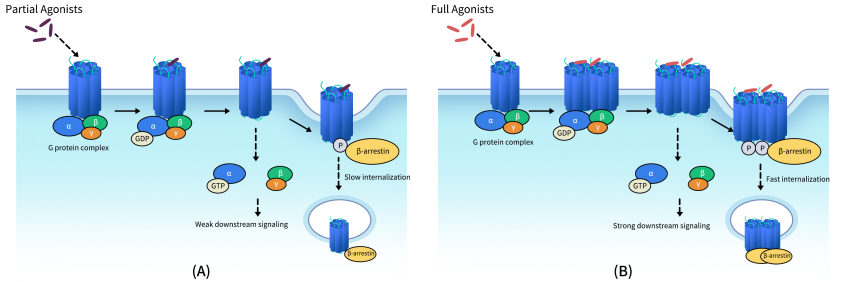
Fig 1. Schematic diagram for relationship of GPCR dimerization and their trans-membrane signal transduction functions. (A) Schematic diagram for signal tranduction of GPCRs activated with partial agonists; (B) Schematic diagram for signal tranduction of GPCRs activated with full agonists.[1]
1.2 CXCR4表达及分布
CXCR4表达广泛,在多种发育阶段和组织类型中均可检测到其表达。CXCR4在胚胎发育过程中发挥关键作用,特别是在造血系统、中枢神经系统和心血管系统的形成中。在成人中,CXCR4主要表达于造血干细胞、免疫细胞(如T细胞、B细胞、单核细胞)、内皮细胞、成纤维细胞以及某些神经元和上皮细胞。此外,CXCR4在多种肿瘤组织中高度表达,与肿瘤转移、浸润及耐药性密切相关。CXCR4因此也成为癌症研究和靶向治疗的重点关注对象。CXCR4的天然配体CXCL12(SDF-1)在多种组织中分泌,与CXCR4具有高亲和力。该配体可与CXCR4特异性结合形成趋化梯度,从而调控细胞的定向迁移。
1.3 CXCR4信号传导
CXCR4的主要配体CXCL12(又名SDF-1)与受体结合后,可激活Gi型G蛋白,进而抑制腺苷酸环化酶(AC)活性,降低细胞内cAMP水平。此外,该受体还可触发PI3K/AKT、MAPK/ERK、JAK/STAT等多种下游信号通路,从而调控细胞增殖、生存、黏附和迁移等生物学过程。受体激活还可导致β-arrestin介导的受体内化与信号偏向(biased signaling),并可能通过不同的聚合状态(如同源或异源二聚体)呈现差异化的信号输出模式。在肿瘤微环境中,CXCL12/CXCR4轴促进肿瘤细胞逃避免疫监视、趋化至转移靶器官并诱导血管生成,因此成为免疫疗法、抗转移策略及干细胞归巢等研究热点。
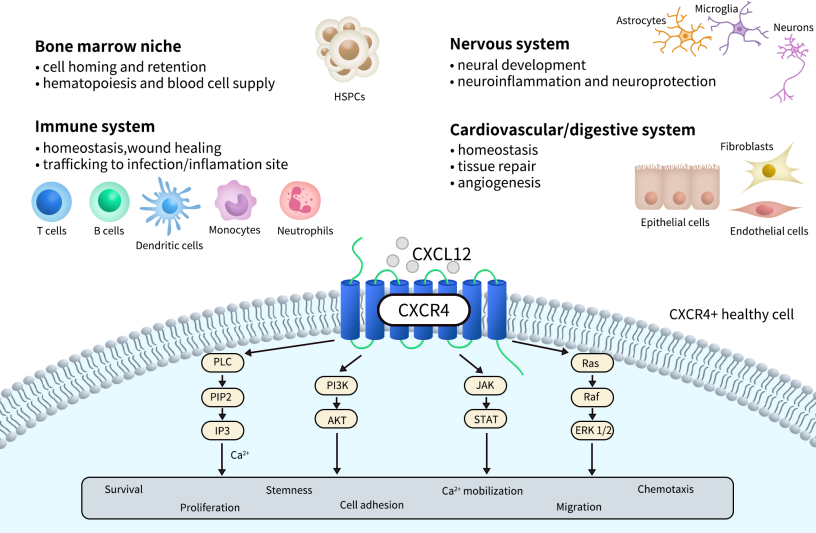
Fig 2. CXCR4 physiological and pathological processes and signaling.[2]
2. CXCR4于疾病治疗的意义
CXCR4作为一种经典的G蛋白偶联受体(GPCR),其在多种疾病中扮演核心角色,具有极高的药物开发价值。
2.1 肿瘤治疗中的关键作用
CXCR4-CXCL12轴是肿瘤微环境重塑与肿瘤转移的重要分子通路之一。

对于这些肿瘤的治疗,目前的策略是使用CXCR4拮抗剂(如Plerixafor、Motixafortide)打破肿瘤细胞与骨髓基质的粘附,有助于化疗敏感性恢复、肿瘤干细胞动员、增强免疫检查点抑制剂效应。
2.2 免疫系统疾病中的调控靶点
CXCR4对免疫细胞(T细胞、B细胞、树突细胞、嗜酸/中性粒细胞等)的迁移、发育、定位起决定作用。
2.2.1 WHIM综合征(罕见病)
病因为CXCR4基因的终止密码子突变(如R334X)使其无法正常内吞,造成持续激活。其临床表现为疣(Warts)、低丙种球蛋白血症(Hypogammaglobulinemia)、感染(Infections)、骨髓保留(Myelokathexis)。2024年FDA批准Mavorixafor用于治疗WHIM,为靶向CXCR4在遗传免疫缺陷病中的成功范例。
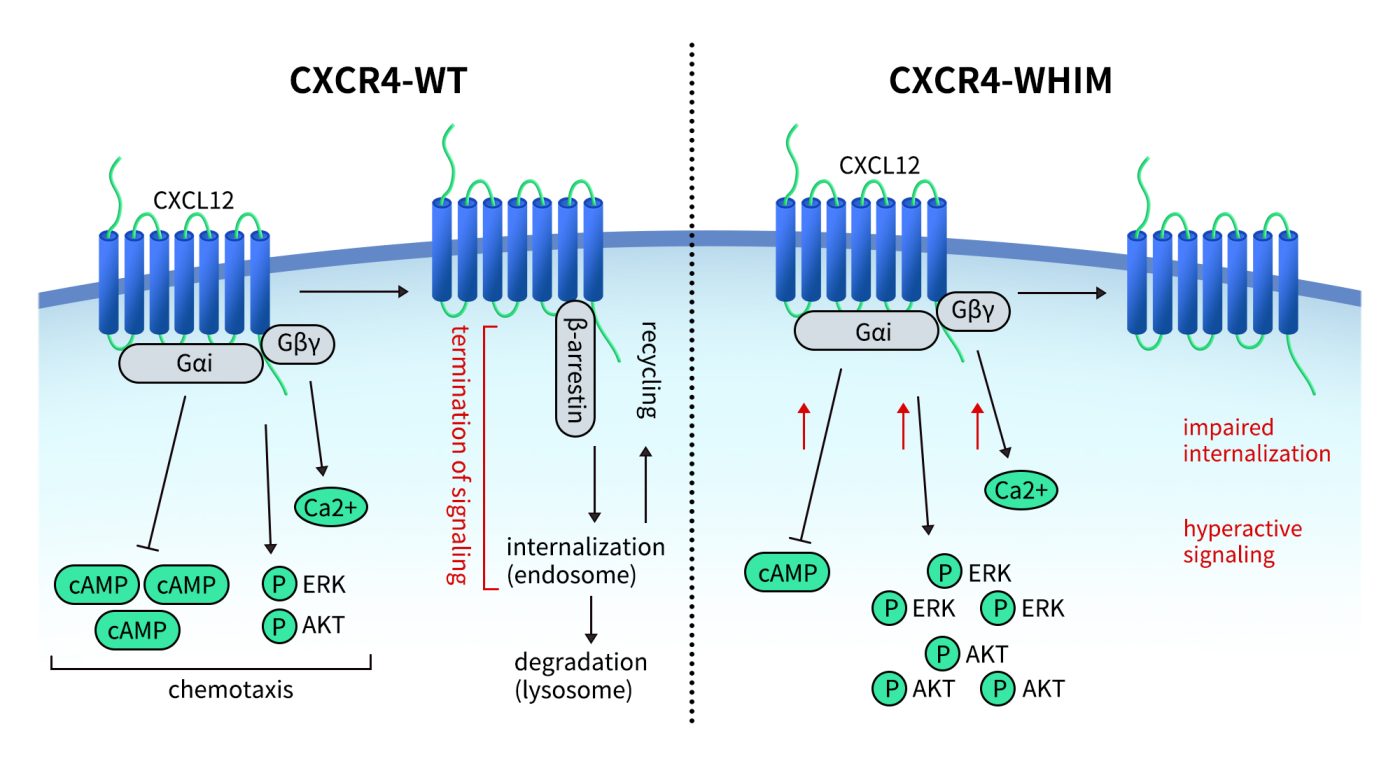
Fig 3.Schematic representation of signaling pathways activated downstream of the CXCR4 receptor and the effect of CXCR4WHIM mutations.[3]
2.2.2 自身免疫/炎症性疾病
在系统性红斑狼疮(SLE)、类风湿性关节炎、炎性肠病中,CXCR4表达升高,驱动炎症细胞聚集;而CXCR4抑制剂可能降低炎症反应、改善组织损伤、限制免疫病灶。
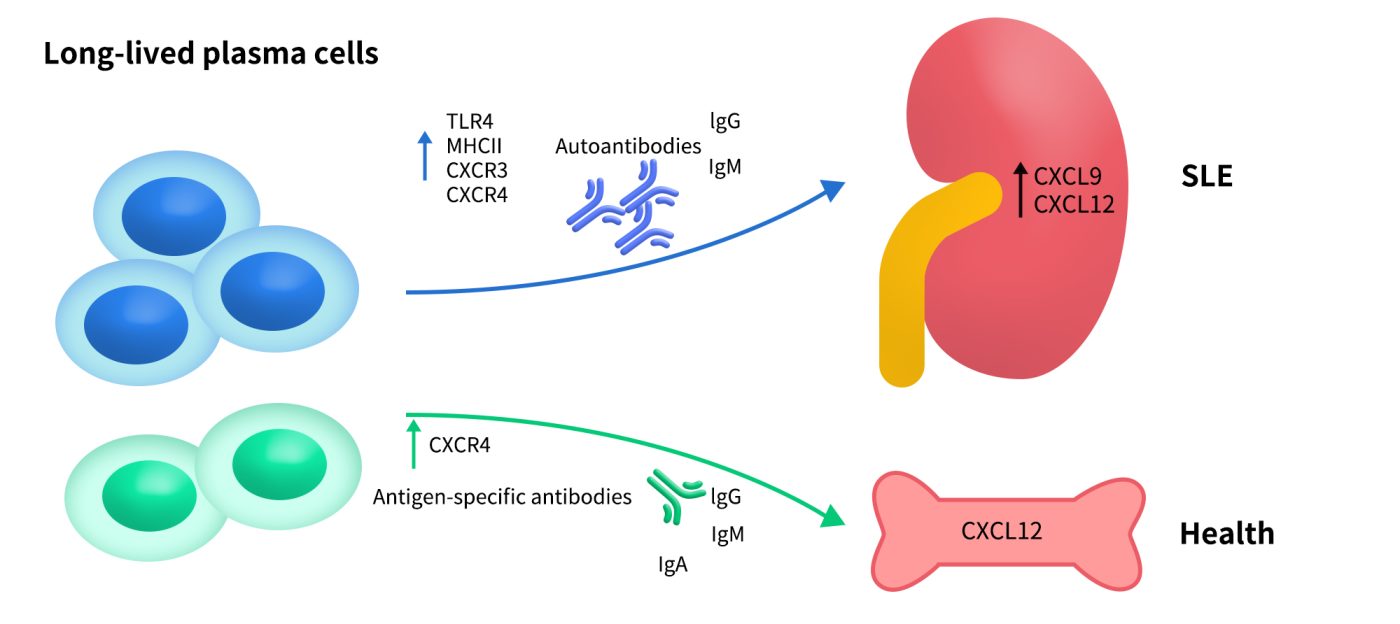
Fig 4. Long-lived plasma cells in SLE. The upregulated CXCL9 and CXCL12 in the inflamed organs of SLE, such as kidney, may recruit the autoreactive long-lived plasma cells to maintain local autoimmune inflammation.[4]
2.3 干细胞治疗与组织修复
CXCR4-CXCL12轴是造血干细胞归巢、保留与动员的关键调控因子。FDA已批准Plerixafor与Motixafortide用于多发性骨髓瘤患者的干细胞动员。此外,CXCR4可调控心脏干细胞、神经前体细胞的迁移与定位,具备心梗后修复、神经损伤后的再生潜力。
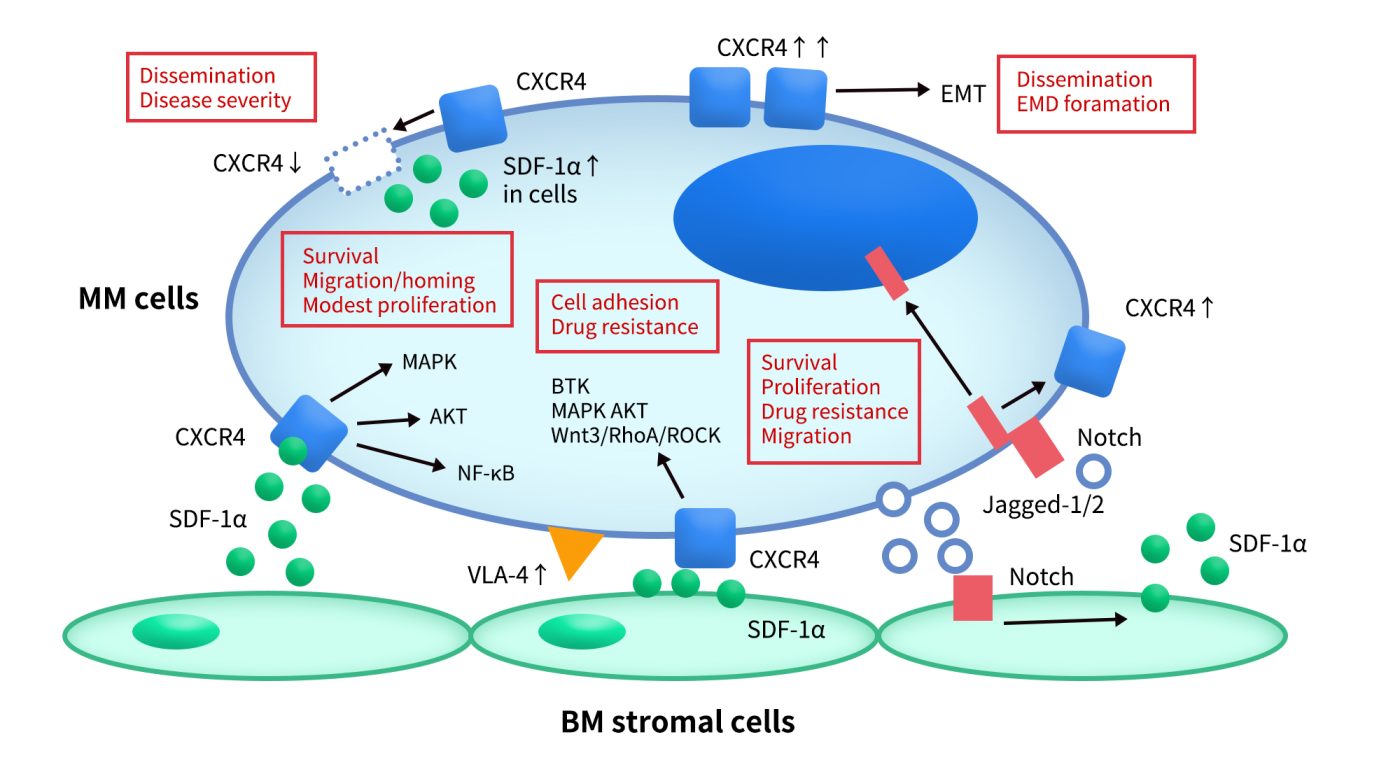
Fig 5.Pleiotropic roles of Stromal cell-derived factor-1α (SDF-1α)/C-X-C chemokine receptor type 4 (CXCR4) axis in multiple myeloma cells. [5]
2.4 HIV感染与病毒入侵机制
CXCR4是HIV-1进入T细胞的两种共受体之一(另一为CCR5);X4嗜性HIV毒株在晚期艾滋病阶段较常见,虽然CXCR4拮抗剂用于HIV治疗仍受限制,但仍为潜在的辅助抑制靶点。
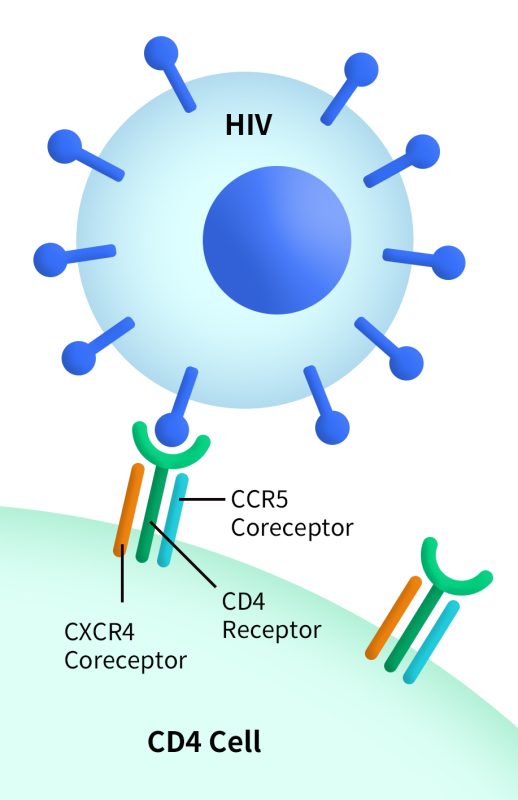
Fig 6.CXCR4 can act as a coreceptor (a second receptor binding site) for HIV when the virus enters a host cell. (https://clinicalinfo.hiv.gov/)
2.5 放射显像与诊断用途
CXCR4靶向显像剂如 68Ga-Pentixafor 可用于:成像肿瘤组织CXCR4表达水平;评估肿瘤异质性、耐药性;筛选适合CXCR4靶向治疗的患者。此类“诊疗一体化”(theranostic)策略正成为肿瘤精准医学的重要组成部分。
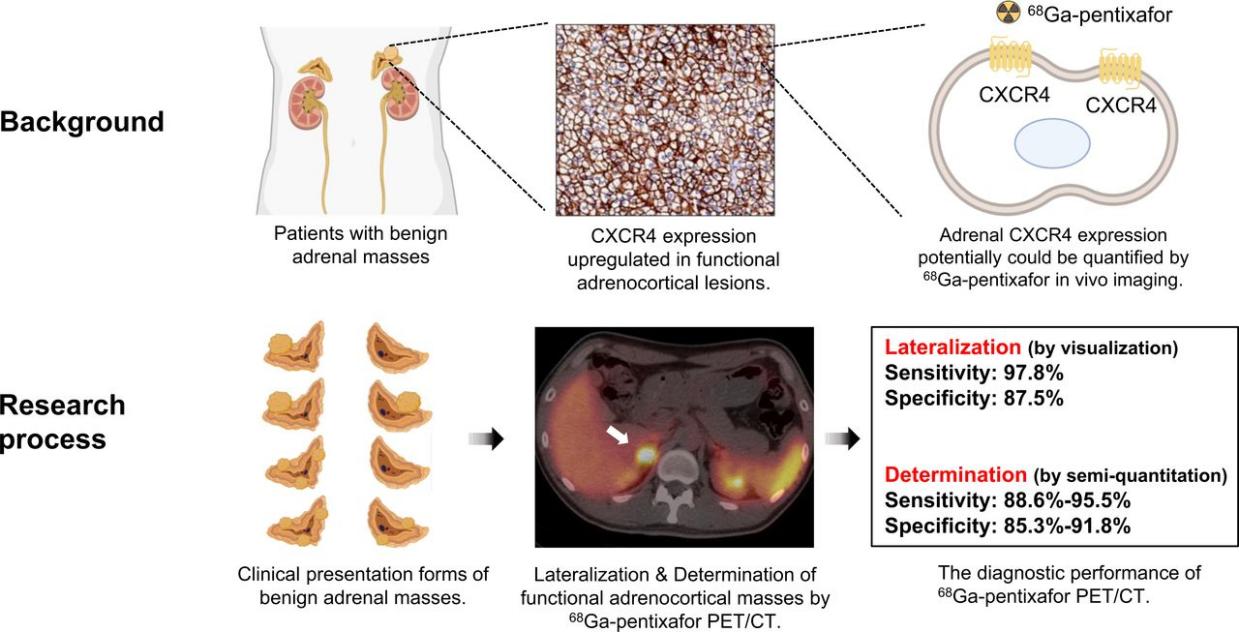
Fig 7.68Ga-pentixafor PET/CT imaging in noncancer patients with suspected adrenal masses. [6]
3. CXCR4靶向药物
目前,靶向CXCR4的药物研发已进入多个治疗领域,包括造血干细胞动员、肿瘤治疗、罕见免疫缺陷病及成像诊断等,药物类型涵盖小分子、肽类、多肽、单克隆抗体、放射性探针及细胞基因疗法等。以下是代表性药物进展概述:
- Plerixafor
最早获批的CXCR4靶向药物是Plerixafor(AMD3100),由Genzyme/Sanofi开发,是一种小分子拮抗剂,通过竞争性阻断CXCR4与其配体CXCL12的结合,促使骨髓中的造血干细胞释放至外周血。2008年,Plerixafor获得FDA批准,用于多发性骨髓瘤和非霍奇金淋巴瘤患者的造血干细胞动员,是CXCR4领域的第一个上市产品。
- Motixafortide
继Plerixafor之后,Motixafortide(BL-8040)成为第二个被批准用于临床的CXCR4拮抗剂。它是一种高亲和力、多肽类小分子,由以色列BioLineRx公司开发,并于2023年获FDA批准,用于联合G-CSF对多发性骨髓瘤患者进行HSPC动员。Motixafortide具有长效作用,可提高干细胞采集效率,同时在多项实体瘤(如胰腺癌)和免疫治疗联合方案中也正在进行探索性研究。
- Mavorixafor
另一个具有突破意义的药物是Mavorixafor(X4P-001),由X4 Pharmaceuticals开发,是针对CXCR4基因突变导致的WHIM综合征(一种罕见免疫缺陷病)设计的小分子拮抗剂。WHIM患者由于CXCR4不能正常内吞,造成信号持续激活。Mavorixafor通过调控CXCR4活性,改善免疫细胞分布,已于2024年4月获FDA批准,是CXCR4在遗传免疫疾病治疗中的首次成功应用。
- Ulocuplumab
在抗体方向,Ulocuplumab(BMS-936564)是Bristol-Myers Squibb开发的一款CXCR4单克隆抗体,具备阻断配体结合并诱导抗体依赖性细胞毒性(ADCC)作用,目前处于AML(急性髓性白血病)、CLL(慢性淋巴细胞白血病)等血液肿瘤的临床I/II期阶段。
- LY2510924
Eli Lilly公司开发的LY2510924是一种肽类拮抗剂,正在多种实体瘤(包括NSCLC、胰腺癌、头颈癌)中进行联合治疗研究。该药物通过CXCR4-CXCL12通路阻断肿瘤细胞迁移,并增强T细胞在肿瘤中的浸润。
- 68Ga-Pentixafor
在分子成像和精准诊断方面,68Ga-Pentixafor是一种放射性标记的小分子CXCR4配体,广泛用于PET/CT显像,用于识别CXCR4高表达肿瘤(如淋巴瘤、前列腺癌、胰腺癌等),并为后续的靶向治疗提供分子影像支持。这类放射性CXCR4显像剂正推动诊疗一体化(theranostic)的实现。
- CXCR4-CAR-T
此外,CXCR4也被用于CAR-T细胞治疗增强中。中国科济药业等机构开发的CXCR4-CAR-T项目通过工程化T细胞表达CXCR4,使其更易穿透肿瘤间质、增强肿瘤浸润性,特别适用于实体瘤如胰腺癌、胃癌等。此类疗法目前处于临床前或早期临床探索阶段。
- POL6326
曾引起关注的还有POL6326(Balixafortide),由瑞士Polyphor(现公司名称Spexis Ltd)开发,曾进入乳腺癌治疗的临床II期,与长春瑞滨联合用于转移性乳腺癌,但由于后期疗效与竞争性原因,该项目已被终止。
- NOX-A12
NOX-A12(Olaptesed pegol)是一种Spiegelmer®类核酸药物,由NOXXON Pharma开发,其作用靶点为CXCL12(而非CXCR4本身),通过中和CXCL12阻断下游CXCR4信号,目前正在胰腺癌和脑胶质瘤等适应症中与放疗联合进行临床I/II期研究。
综上,CXCR4靶向药物的研发已形成从传统小分子到抗体、肽类、放射性探针乃至细胞疗法的多元格局,其临床应用已从造血干细胞动员扩展至肿瘤治疗、遗传免疫病、精准诊断与细胞治疗增强等多个领域。随着靶点理解的深入与技术平台的拓展,CXCR4在未来精准医疗体系中的战略地位将持续提升。
4. 缔码CXCR4靶点相关产品
缔码现可提供一系列CXCR4靶点的现货产品,产品包括重组蛋白、全长膜蛋白,重组单克隆抗体及Biosimilar参照抗体。同时,我们还可以提供系统的服务,包括蛋白/抗体定制服务、抗体人源化、抗体亲和力成熟、稳转细胞株等。此外,我们已经建立了CXCR4靶点的B细胞种子库,可在短短20天内筛选出客户所需的先导抗体分子。如需了解更多详情,欢迎垂询。(400-006-0995 / 18062749453)
- 重组蛋白
Human CXCR4 Protein, hFc Tag (Cat.No.PME100834)
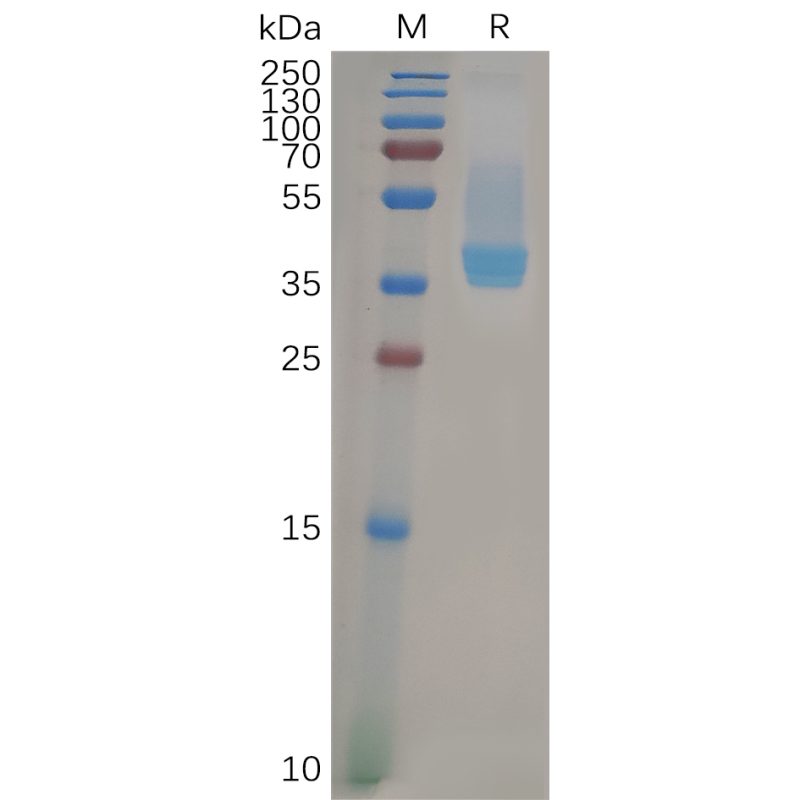
Human CXCR4 Protein, hFc Tag on SDS-PAGE
- 全长膜蛋白
Human CXCR4 full length protein-synthetic nanodisc (Cat.No.FLP100074)
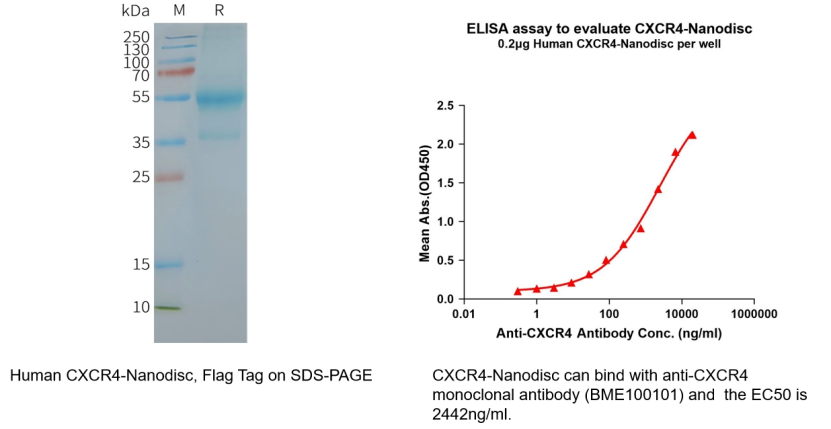
Biotinylated Human CXCR4 full length protein-synthetic nanodisc (Cat.No.FLP100074B)
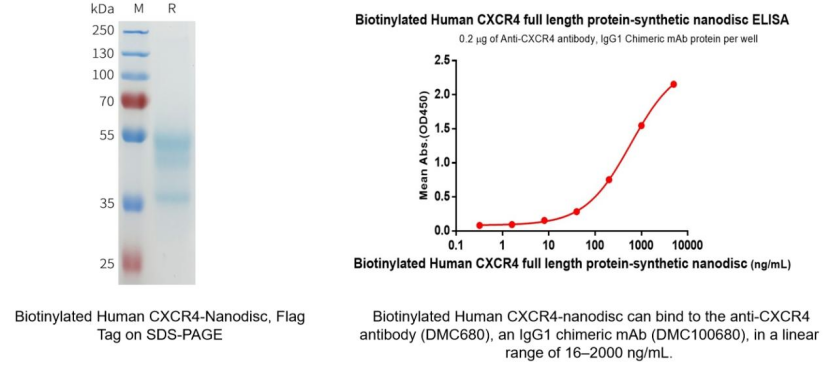
- 单克隆抗体
Anti-CXCR4 antibody(DMC680), IgG1 Chimeric mAb (Cat.No.DMC100680)
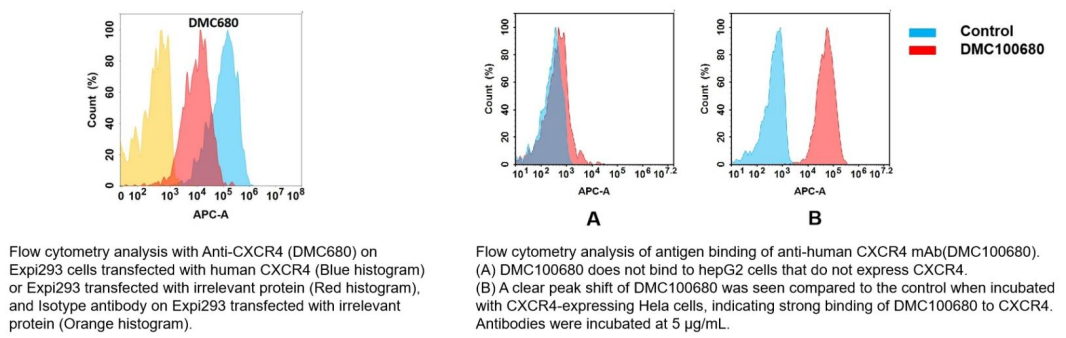
- Biosimilar 参照抗体
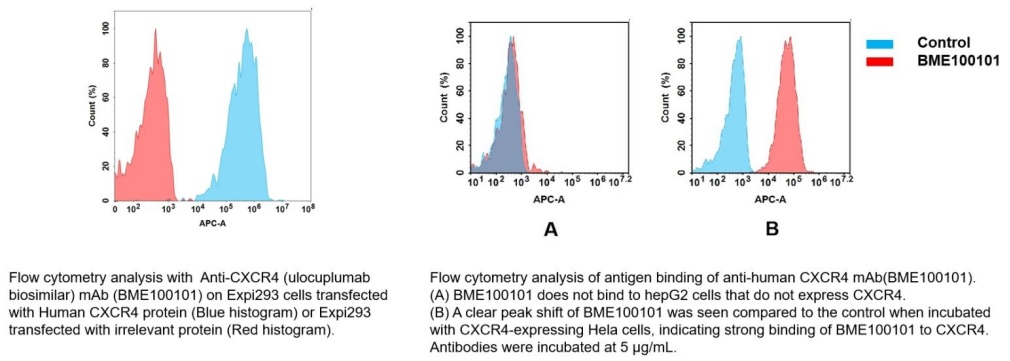
Anti-CXCR4(ulocuplumab biosimilar) mAb (Cat.No.BME100101)
- CXCR4靶点相关产品
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100834 | Human CXCR4 Protein, hFc Tag |
| 全长膜蛋白 | FLP120074 | Human CXCR4-Strep full length protein-synthetic nanodisc |
| FLP100074 | Human CXCR4 full length protein-synthetic nanodisc | |
| FLP100074B | Biotinylated Human CXCR4 full length protein-synthetic nanodisc | |
| 重组单克隆抗体 | DMC100680 | Anti-CXCR4 antibody(DMC680), IgG1 Chimeric mAb |
| Biosimilar参照抗体 | BME100101 | Anti-CXCR4(ulocuplumab biosimilar) mAb |
| 生物素标记抗体 | DMC100680B | Biotinylated Anti-CXCR4 antibody(DMC680), IgG1 Chimeric mAb |
| BME100101B | Biotinylated Anti-CXCR4(ulocuplumab biosimilar) mAb | |
| PE荧光标记抗体 | DMC100680P | PE-conjugated Anti-CXCR4 antibody(DMC680), IgG1 Chimeric mAb |
| BME100101P | PE-conjugated Anti-CXCR4(ulocuplumab biosimilar) mAb |
- CXCR4先导分子研究进度

参考文献.
- Ge, B., J. Lao, J. Li, Y. Chen, Y. Song and F. Huang (2017). “Single-molecule imaging reveals dimerization/oligomerization of CXCR4 on plasma membrane closely related to its function.” Sci Rep 7(1): 16873.
- RUEDA, A., SERNA, N., MANGUES, R., VILLAVERDE, A. & UNZUETA, U. 2025. Targeting the chemokine receptor CXCR4 for cancer therapies. Biomark Res, 13, 68.
- ZMAJKOVICOVA, K., PAWAR, S., MAIER-MUNSA, S., MAIERHOFER, B., WIEST, I., SKERLJ, R., TAVERAS, A. G. & BADARAU, A. 2022. Genotype-phenotype correlations in WHIM syndrome: a systematic characterization of CXCR4(WHIM) variants. Genes Immun, 23, 196-204.
- MA, K., DU, W., WANG, X., YUAN, S., CAI, X., LIU, D., LI, J. & LU, L. 2019. Multiple Functions of B Cells in the Pathogenesis of Systemic Lupus Erythematosus. Int J Mol Sci, 20.
- ITO, S., SATO, T. & MAETA, T. 2021. Role and Therapeutic Targeting of SDF-1alpha/CXCR4 Axis in Multiple Myeloma. Cancers (Basel), 13.
- Ding, J., et al., Functional Characterization of Adrenocortical Masses in Nononcologic Patients Using (68)Ga-Pentixafor. J Nucl Med, 2022. 63(3): p. 368-375.


