CCR1(C-C motif chemokine receptor 1,C-C趋化因子受体1)是一种参与炎症反应和免疫细胞迁移的G蛋白偶联受体(GPCR)。近年来,随着对免疫疾病和肿瘤微环境的深入研究,CCR1 逐渐成为自身免疫疾病、肿瘤和器官纤维化等疾病的重要药物靶点。
1. CCR1 概述
趋化因子单体由一个中央三股β折叠结构组成,其上覆盖有一个C端α螺旋结构,并且具有一个结构不稳定但对受体激活至关重要的N端区域。趋化因子之间具有高度同源性,其基因和氨基酸序列约有20%–50%相同。根据其N端半胱氨酸的排列方式,趋化因子可分为四个亚类:CXC、CC、C和CX3C。其中,CC和CXC是两个主要的亚类:CC类趋化因子的前两个半胱氨酸相邻,而CXC类趋化因子则在两个半胱氨酸之间夹有一个氨基酸残基。C类趋化因子缺少第一个和第三个半胱氨酸,而CX3C类趋化因子则在前两个半胱氨酸之间插入了三个氨基酸残基。
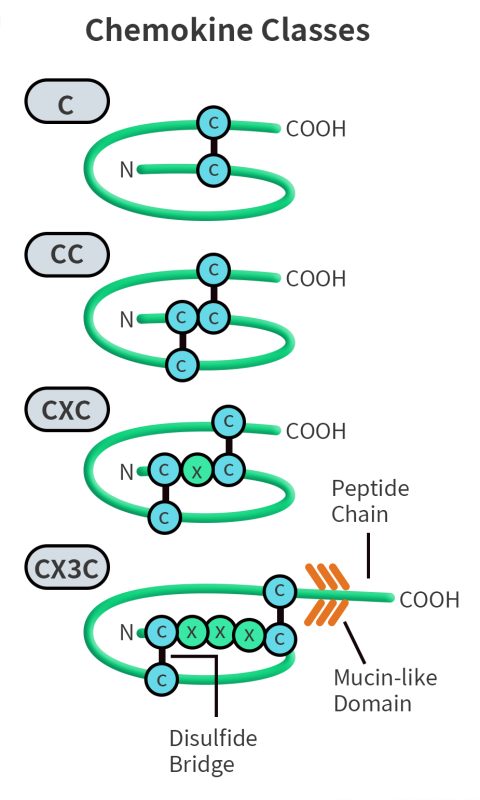
Fig 1.CC Chemokine Family Classification.[1]
CC类趋化因子受体(CCR)是G蛋白偶联受体家族的重要成员,具有七个跨膜α螺旋结构。该受体的跨膜结构将其分为细胞内C端、三个胞内环、三个胞外环以及一个胞外N端。G蛋白与其中一个胞内环结合后启动细胞内信号级联反应,从而调控多种生物功能。趋化因子受体由约340~370个氨基酸组成,其氨基酸同源性在25%~80%之间。根据可结合的趋化因子配体类型,趋化因子受体可分为四个亚类:CXCR、CCR、XCR和CX3CR。
CCR1属于CC类趋化因子受体家族,主要与CCL3(MIP-1α)、CCL5(RANTES)、CCL7、CCL23 等配体结合,诱导免疫细胞的迁移与活化。作为G蛋白偶联受体(GPCR)成员之一,CCR1拥有典型的7次跨膜结构。
- 其结构要点:N端胞外域:负责配体结合
- 跨膜螺旋区域:7次跨膜α螺旋是信号激活的核心
- 细胞内回路(ICL):调节与G蛋白和arrestin的相互作用
- C端胞内结构域:调控受体内化与信号终止
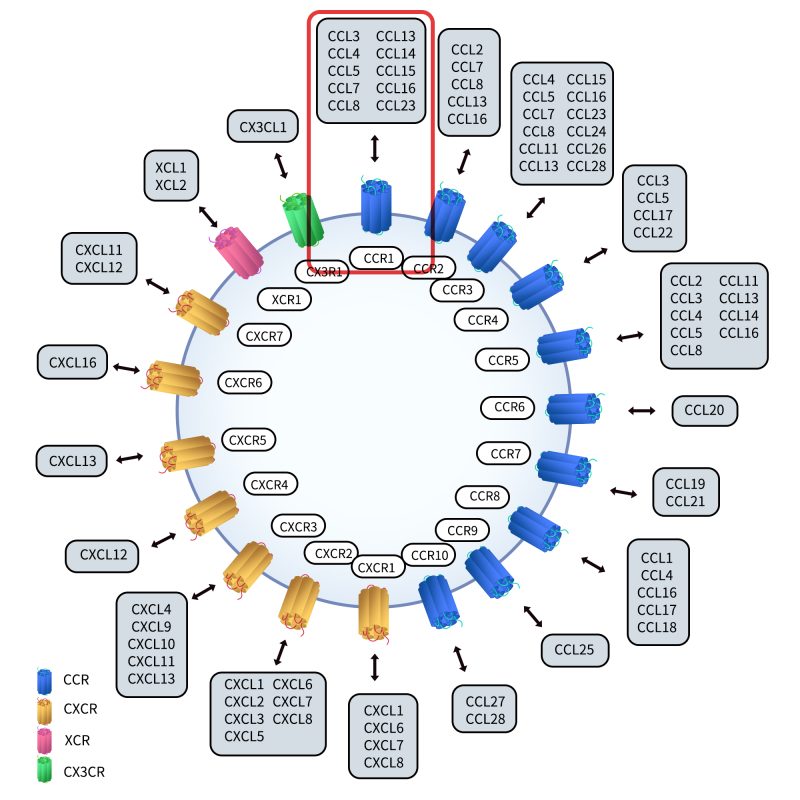
Fig 2.CCR Classification.[2]
目前尚无CCR1的高分辨率晶体结构,但通过同源建模可推测其与其它CC类趋化因子受体(如 CCR5)有高度结构相似性。
2. CCR1表达与信号通路
2.1 CCR1表达
CCR1主要表达在多种免疫细胞的细胞膜上,包括单核细胞、未成熟树突状细胞、T淋巴细胞、嗜碱粒细胞、嗜酸粒细胞、中性粒细胞、自然杀伤细胞(NK细胞)、肥大细胞、内皮细胞、人脐带血(HUCB)细胞及其他细胞,主要介导趋化因子信号转导。此外,已有部分研究证实CCR1还在中枢神经系统(CNS)非造血细胞中表达。既往研究发现,CCR1可在脑内多种细胞类型中表达,包括微血管内皮细胞、血管平滑肌细胞、小胶质细胞、星形胶质细胞和神经元。其功能主要包括:①介导免疫细胞趋化:响应炎症信号向病灶区域迁移;②调控细胞活化与炎症因子释放;③促进抗原呈递与免疫记忆形成;④在免疫稳态与应激反应中,CCR1是免疫系统精准导航的重要“GPS”。
2.2 CCR1介导的信号通路
CCR1主要与CCL3、CCL5等配体结合,介导免疫细胞(如单核细胞、巨噬细胞、T 细胞等)向炎症部位迁移。CCR1激活后可通过Gi蛋白下调cAMP水平、激活PI3K/Akt和 PLC/Ca2+/PKC通路,同时也可通过β-arrestin启动MAPK信号,调控细胞的趋化、黏附、活化与炎症反应。CCR1信号在多种炎症、自身免疫性疾病以及肿瘤微环境中发挥重要作用。
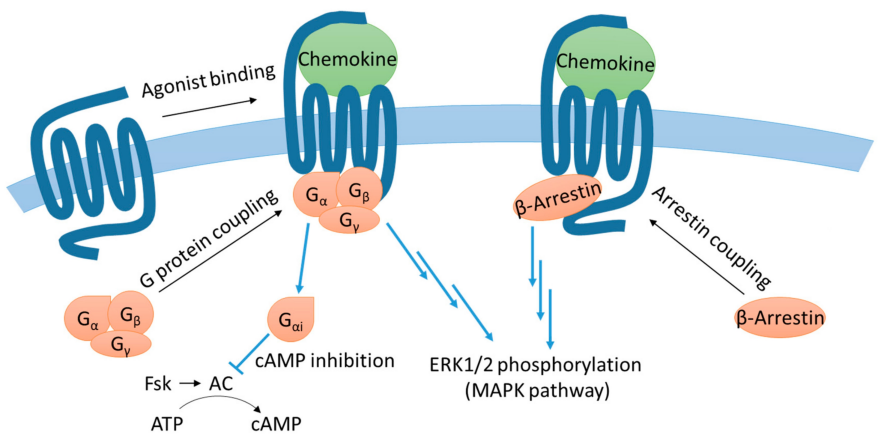
Fig 3.Simplified diagram of CCR1 signaling pathway.[3]
3. CCR1相关疾病
CCR1的过度活化或表达异常与多种疾病密切相关:
3.1 自身免疫与炎症性疾病
类风湿性关节炎(RA):CCR1+单核细胞和巨噬细胞可迁移至滑膜组织,引发炎症与骨破坏。
多发性硬化症(MS):CCR1调控中枢神经系统中免疫细胞浸润,参与脱髓鞘病变。
炎症性肠病(IBD):CCR1表达升高与肠道黏膜中免疫细胞异常活化相关。
3.2 肿瘤免疫与转移
在多种实体瘤中(如乳腺癌、前列腺癌),CCR1促进肿瘤相关巨噬细胞(TAM)募集,助力肿瘤免疫逃逸与侵袭扩散。
某些癌细胞也可表达CCR1,增强其对趋化因子的反应性,促进转移。
3.3 器官纤维化
在肺纤维化和肾小球肾炎中,CCR1调节炎症细胞和成纤维细胞的迁移与活化,是组织纤维化的“导火索”。
4. CCR1 药物研发进展
尽管目前尚无CCR1靶向药物获批上市,但多款候选药物已进入临床试验阶段,主要集中在炎症、自免和癌症适应症上,目前有4款在研药物,涵盖DNA疫苗、小分子化药、抗体类药物及溶瘤病毒等多种药物类型。美国奥斯陆大学开发的CCL3-containing Id疫苗通过CCR1拮抗机制,用于治疗多发性骨髓瘤,目前处于临床前阶段;德克萨斯大学El Paso分校的SSFF-02靶向CCR1/3/5,为乳腺癌治疗提供了新的化学药候选;City of Hope医学中心的OV-Cmab-CCL5则结合CCR1与EGFR双靶点,开发用于胶质母细胞瘤的溶瘤病毒疗法;勃林格殷格翰则布局CCR1小分子拮抗剂(CCR1 antagonists),用于自身免疫性疾病和炎症领域,目前处于药物发现阶段。
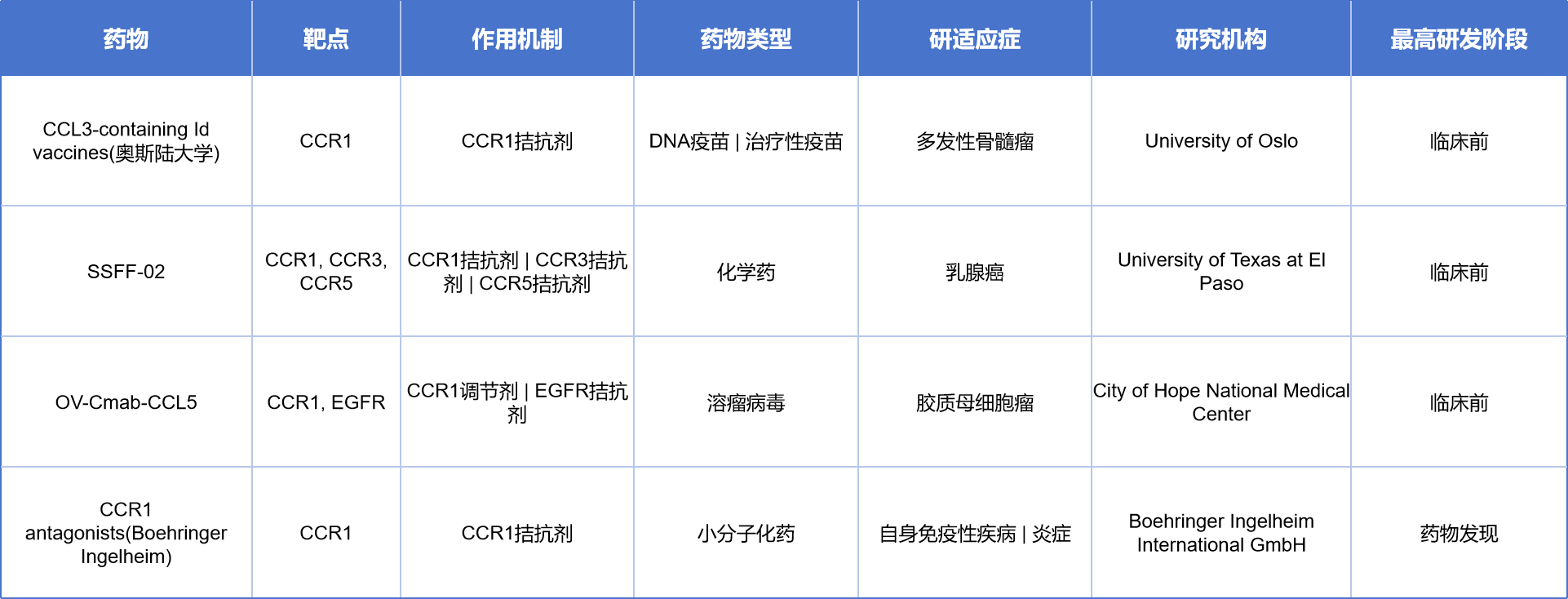
另有16款药物均处于无进展或终止状态,其中多款CCR1拮抗剂已推进至临床I/II期,适应症主要包括炎症、类风湿性关节炎及多发性硬化等疾病:
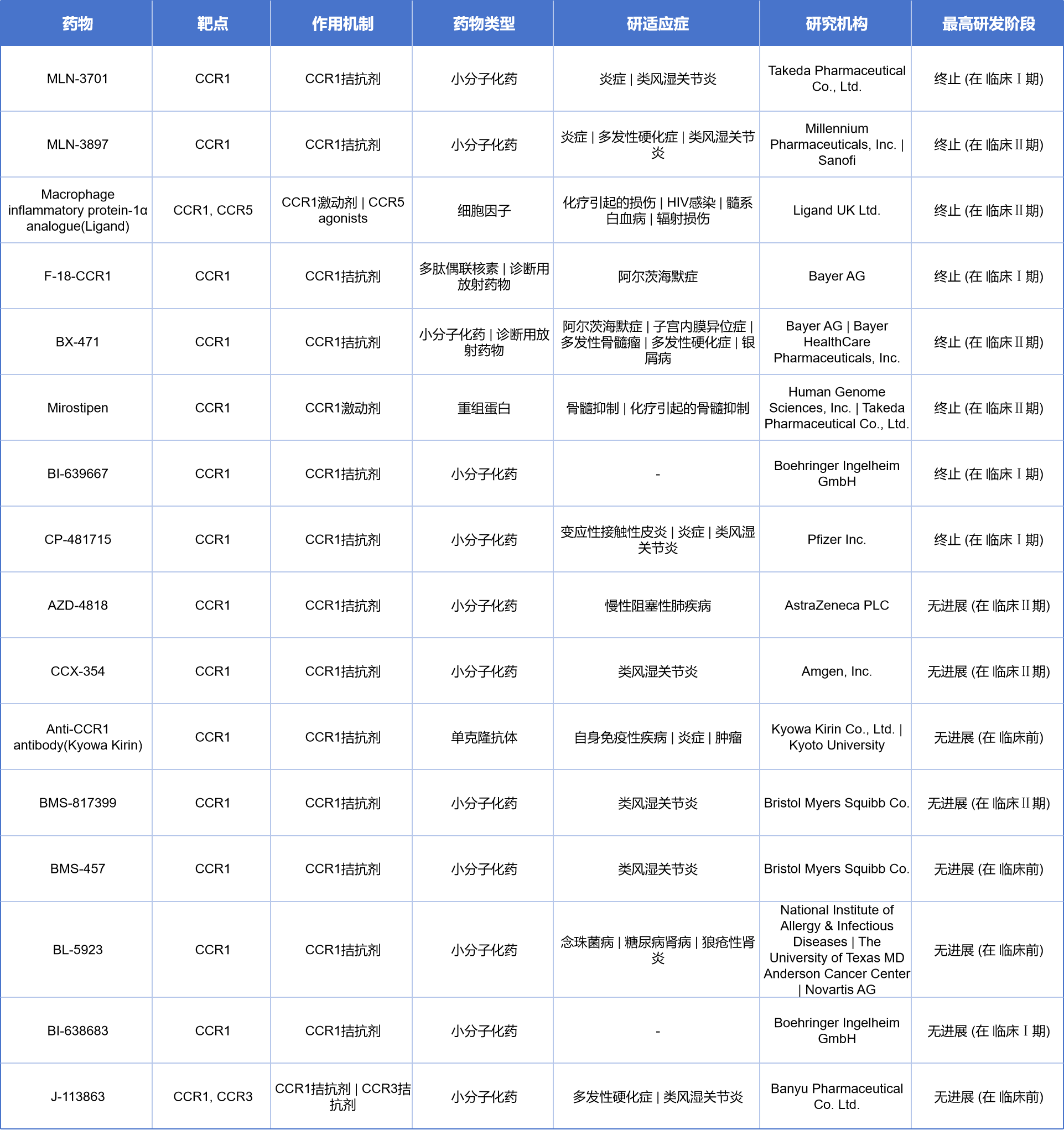
Takeda的MLN-3701 和 Millennium/Sanofi的MLN-3897 均为小分子CCR1拮抗剂,适应症覆盖炎症、多发性硬化与类风湿性关节炎,目前已终止(在临床I期)。
Bayer AG的F-18-CCR1为诊断用放射性配体,用于阿尔茨海默病的成像探索。
BX-471 被用于自身免疫病如银屑病与器官移植相关的排异反应,研发由Bayer主导,也已终止于临床I期。
Mirostipen 是一款CCR1激动剂,原用于骨髓抑制与造血干预,由Human Genome Sciences和武田制药共同研发,也已终止。
另外还有些项目前在临床阶段无进展:
Kyowa Kirin的Anti-CCR1 antibody 为CCR1单抗,用于炎症和自身免疫疾病,目前处于药物发现/早期研究阶段。
AZD-4818(AstraZeneca)、CCX-354(Amgen)、BMS-457 与 BMS-817399 这几款CCR1小分子拮抗剂则用于类风湿性关节炎、慢性炎症等,目前均处于临床前或早研阶段。
除了针对单个靶点的药物,还有两款针对多个靶点的联合多功能药物(CCR3、CCR5):
Macrophage inflammatory protein-1α analogue由Ligand开发,同时作用于CCR1与CCR5,是一款趋化因子类生物药,探索用于HIV感染、化疗诱导损伤等。
J-113863(Banyu) 同时拮抗CCR1与CCR3,用于多发性硬化等疾病,处于临床前阶段。
CCR1靶点目前暂无相关批准上市药物,其开发难点在于:·
受体冗余:CCR1 与 CCR5、CCR3 等趋化因子受体功能重叠,单靶点干预疗效有限。
选择性与安全性平衡:需避免影响正常免疫防御功能。
靶点验证缺乏结构数据支撑:限制理性药物设计(SBDD)。
CCR1 是连接炎症、免疫与肿瘤的重要桥梁。尽管药物研发面临靶点冗余和选择性挑战,但在类风湿性关节炎、肿瘤免疫治疗与器官纤维化等领域仍展现出巨大潜力。
5. 缔码CCR1靶点相关产品
缔码现可提供一系列CCR1靶点的现货产品,产品包括重组蛋白、全长膜蛋白,重组单克隆抗体,生物素/PE标记抗体及CDX切片。同时,我们还可以提供系统的服务,包括蛋白/抗体定制服务、抗体人源化、抗体亲和力成熟、稳转细胞株等。此外,我们已经建立了CCR1靶点的B细胞种子库,可在短短20天内筛选出客户所需的先导抗体分子。如需了解更多详情,欢迎垂询。(400-006-0995 / 18062749453)
•蛋白&抗体&CDX切片
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100921 | Human CCR1 Protein, hFc Tag |
| 全长膜蛋白 | FLP120094 | Human CCR1-Strep full length protein-synthetic nanodisc |
| FLP100094 | Human CCR1 full length protein-synthetic nanodisc | |
| 重组单克隆抗体 | DMC100465 | Anti-CCR1 antibody(DMC465); IgG1 Chimeric mAb |
| 生物素标记抗体 | DMC100465B | Biotinylated Anti-CCR1 antibody(DMC465); IgG1 Chimeric mAb |
| PE荧光标记抗体 | DMC100465P | PE-conjugated Anti-CCR1 antibody(DMC465); IgG1 Chimeric mAb |
| CDX切片 | SLI100002 | Balb/C nu MM.1S DiSliceX™ SlideSet |
- CCR1先导分子研究进度

参考文献:
- Markl, F., et al., Utilizing chemokines in cancer immunotherapy. Trends Cancer, 2022. 8(8): p. 670-682.
- Vilgelm, A.E. and A. Richmond, Chemokines Modulate Immune Surveillance in Tumorigenesis, Metastasis, and Response to Immunotherapy. Front Immunol, 2019. 10: p. 333.
- Sanchez, J., et al., Influence of Chemokine N-Terminal Modification on Biased Agonism at the Chemokine Receptor CCR1. Int J Mol Sci, 2019. 20(10).
- Gilchrist, A. and S.L. Echeverria, Targeting Chemokine Receptor CCR1 as a Potential Therapeutic Approach for Multiple Myeloma. Front Endocrinol (Lausanne), 2022. 13: p. 846310.
- Tian, Q., et al., Inflammatory Role of CCR1 in the Central Nervous System. Neuroimmunomodulation, 2024. 31(1): p. 173-182.


