2012年,患有急性淋巴性白血病的女孩Emily Whitehead接受了宾夕法尼亚州科学家Carl June教授的第二代CD19 CAR-T细胞治疗,成为第一位吃“CAR-T细胞免疫疗法”这只螃蟹的儿童,并且大获成功。这一成功案例让CAR-T疗法名声大噪,也为其临床应用开辟了新的道路。自2017年FDA批准了两款CAR-T疗法产品以来,目前美国已上市6款CAR-T相关产品,尽管中国起步相对较晚,但现也已有3款CAR-T产品上市。目前,全球CAR-T的研发管线正在迅速扩张,除了对新靶点的探索,还涉及实体瘤等新适应症的拓展。那CAR-T究竟是是什么?血液肿瘤和实体瘤中分别有哪些靶点布局CAR-T?在介绍CAR-T疗法之前,我们先来了解下CAR分子发展历程……
1. CAR分子的发展历程
嵌合抗原受体(CAR)的概念首次出现需要追溯到1989年,以色列科学家Prof. Zelig Eshhar在研究T细胞受体(TCR)的过程中发现B细胞产生的抗体和 T 细胞受体(TCR)结构相似,具有恒定区和可变区。抗体的可变区能特异性识别抗原,但TCR只能与主要组织相容性复合物(MHC)呈递的抗原片段结合。如果能将抗体的可变区转移到TCR的恒定区上,这就能够改变TCR的抗原特异性。于是,Eshhar 博士率先提出嵌合抗原受体(CAR)的概念,并成功构建了第一代CAR。CAR基本由细胞外结构域、跨膜区域和胞内结构域3部分组成。胞外结构域是抗原结合部位,胞内结构域是细胞内信号传导区域。经过30多年的发展与改进,CAR-T也经历了从一代到四代的多次迭代,每一代CAR都各有特点。
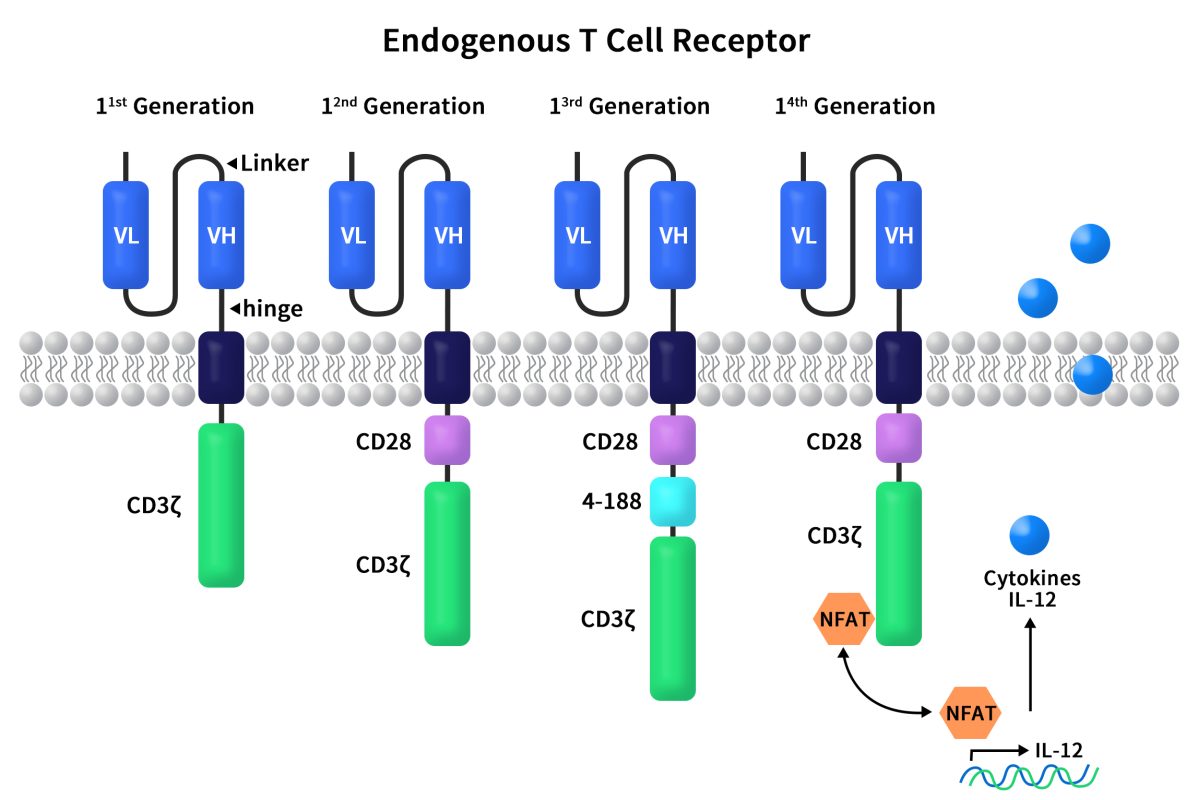
图1 CAR分子的迭代[1,2]
如图一所示,一代CAR包含CD3ζ和scFv,是将抗体的scFv与CD3ζ直接融合。处理后的T细胞在小鼠模型中显示出抗癌活性 [3],但一代CAR-T细胞扩增慢和持久性差,在在临床试验和人体抗癌方面效果不佳。与一代CAR相比,二代CAR增加了1个共刺激受体信号,可以让CAR-T细胞在准确找到癌细胞的同时有效扩增,并对肿瘤产生良好地杀伤效果。这个共刺激受体信号源于共刺激受体CD28或4-1BB,位于跨膜区和CD3信号传导域之间。二代CAR目前拥有的临床数据最多,稳定性最高,工艺也最为成熟。三代CAR是在二代基础上再引入1个共刺激域(CD28和4-1BB或OX40),以期望达到更好的信号传导的效果。然而共刺激信号数量与信号传导效果并不是完全呈正相关的。四代CAR是在二代CAR的基础上引入了一个细胞内结构域共表达一些小分子物质(如促炎症细胞因子IL-12),能够诱发由细胞因子触发的信号通路或者阻断影响CAR-T细胞功能的一些信号通路。在临床前模型中,与第二代CAR相比,共表达细胞因子结构域的存在大大增强了CAR-T细胞疗法的疗效,而且还成功地避免了全身毒性。
2、CAR-T疗法工作原理
嵌合抗原受体T细胞(Chimeric Antigen Receptor T)免疫疗法,简称CAR-T,是通过向T细胞中导入人工设计的CAR分子,使T细胞具有全新的靶向活化功能。当抗原为癌细胞表面的抗原时,T细胞就可以特异的和癌细胞结合,从而通过细胞杀伤作用来对癌细胞进行杀伤。
在临床上,CAR T 疗法通常分为五步:
一是通过白细胞分离术获得患者外周血中T细胞;
二是通过基因工程技术体外构建CAR-T细胞;
三是体外扩大培养CAR-T细胞;
四是将足够数量的CAR-T细胞回输到患者体内;
五是CAR-T细胞的胞外结构域与癌细胞表面抗原结合并对癌细胞进行杀伤,回输的前几天需要密切关注患者的身体反应。
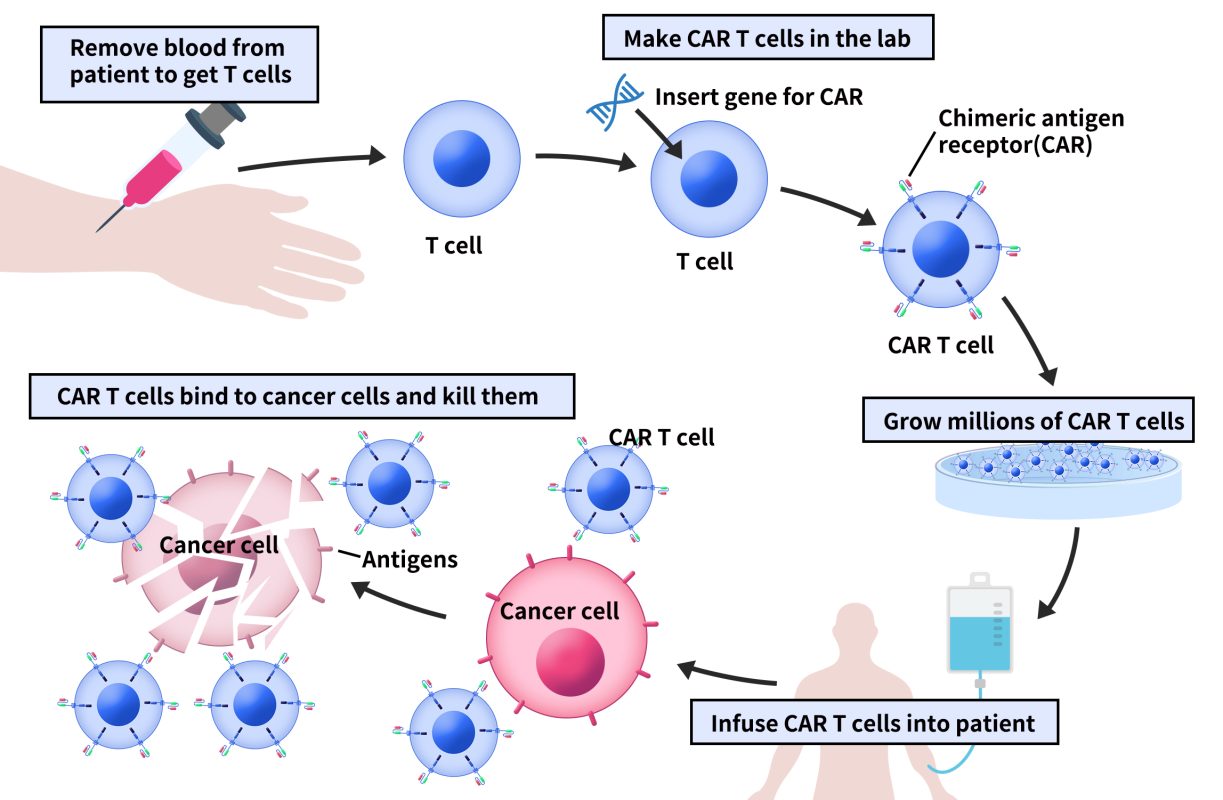
图2 CAR-T细胞疗法步骤
3、CAR-T靶点与肿瘤
自2012年Emily经CAR-T治疗痊愈后,CAR-T疗法凭借在血液肿瘤领域的出色疗效大放异彩,被称为最有希望的肿瘤免疫疗法之一。随着CAR-T疗法的不断发展与优化,CAR-T疗法的适应症也逐步拓展到了实体瘤的治疗。但无论是血液肿瘤还是实体瘤,CAR-T治疗靶点的选择是该疗法是否能成功应用的关键。CAR-T靶点选择通常考虑两方面因素,一是选择的靶点能特异性的在肿瘤细胞表达;二是该靶点能够通过CAR-T细胞的效应分子来识别和攻击癌细胞。
3.1 血液肿瘤中热门CAR-T靶点
目前,针对血液肿瘤的CAR-T疗法,全球共有8款产品获批上市,有近350款CAR-T产品处于临床阶段,适应症主要集中在淋巴细胞性白血病和非霍奇金淋巴瘤。针对血液肿瘤的CAR-T靶点共20多种,当前临床进展较快的项目还是以CD19和BCMA为靶点,其他研究比较多的靶点还有CD138、CD33、CD7、CD22、CD20、CD30、CD123等。另外,随着研究的不断深入,也出现了CD38、GPRC5D、CD33、ROR1等新兴靶点。CD19为I型单次跨膜糖蛋白,在B细胞发育早期和成熟B细胞阶段表达,是B细胞表面生物标志物之一。CD19能与补体受体CD21和CD81一起构成成熟B细胞表面多分子复合物的主要信号传导成分,在维持体液、抗原诱导和耐受诱导之间的平衡中起着关键作用。目前临床上针对血液肿瘤适应症, CD19是所有血液肿瘤CAR-T靶点临床项目数最多的靶点。该靶点的CAR-T产品涉及单靶点CAR、双靶点等多种类型。其中双靶点CAR多是与CD22或CD20组合。
BCMA是III型单穿膜跨膜蛋白,又称为TNFRSF17,是肿瘤坏死因子受体(TNFR)家族的一员。该受体主要表达于成熟B淋巴细胞及浆细胞表面,是B淋巴细胞成熟标志物。目前临床上针对多发性骨髓瘤瘤适应症。
GPRC5D是G蛋白偶联受体家族成员,为7次跨膜蛋白,属于一种孤儿受体,在多发性骨髓瘤细胞中特异性高表达。目前临床上以GPRC5D为CAR-T靶点的项目共有8项,其中处于临床二期和临床一期的均有4项。8项产品CAR-T产品中有三项是与BCMA组合的双靶点CAR。
CD38是一种具有外酶功能的II型单次跨膜糖蛋白,在浆细胞以及其他淋巴和髓样细胞群体上低量表达,也是多发性骨髓瘤治疗靶点。
3.2 实体瘤中热门CAR-T靶点
关于实体瘤的CAR-T产品,正如前面所提到的,CAR-T疗法在实体瘤中的研究比血液肿瘤起步晚,目前处于临床阶段的CAR-T产品数量仅50项,大多数还是处于临床前研究。目前临床研究比较多的实体瘤CAR-T靶点有MSLN、Claudin 18.2、PD-1、HER2、NKG2D ligands和CEACAM5。另外,随着研究的不断开展,也有部分针对实体瘤的CAR-T产品进入临床,这些产品的靶点包括ROR1、GD2、GPC3、CD70、、MUC1、CLDN6、CTLA4、EGFR、AXL、FAP等。这些处于临床阶段的CAR-T疗法针对的适应症主要集中在食管癌、胃癌、肝癌、结直肠癌、胰腺癌、胆管癌等。
MSLN(间皮素,Mesothelin)是细胞表面糖蛋白,在肿瘤(比如恶性间皮瘤、胰腺癌、卵巢癌等)中的表达非常广泛。目前临床上针对实体瘤适应症,以MSLN为靶点的CAR-T项目共有10项,其中4项在临床二期,6项在临床一期,临床前研究还有5项。
Claudin 18.2是紧密连接蛋白家族Claudins中的成员之一,是四穿膜蛋白。在正常组织中,Claudin18.2仅在分化的胃粘膜上皮细胞中表达。病理状态下,Claudin18.2在多种肿瘤(比如胃癌、食管癌、肺癌等)中的表达显著上调。目前临床上针对实体瘤适应症
4、缔码CAR-T先导分子筛选实验平台
自2019年起,我们已经完成针对300+可成药靶点的抗体先导分子开发,其中20+热门CAR-T靶点(比如BCMA、CD123、CD38、CD70、GPRC5D、FCRL5、5T4、CLDN18.2等)完成了CAR分子体外验证。此外,缔码生物现在已拥有良好的CAR-T细胞制备体系,客户能够直接从我们这里拿CAR-T细胞去做杀伤等功能实验。
4.1 平台流程
自2019年起,我们已经完成针对400+可成药靶点的抗体先导分子开发,其中20+热门CAR-T靶点(比如BCMA、CD123、CD38、CD70、GPRC5D、FCRL5、5T4、CLDN18.2等)完成了CAR分子体外验证。此外,缔码生物现在已拥有良好的CAR-T细胞制备体系,客户能够直接从我们这里拿CAR-T细胞去做杀伤等功能实验。
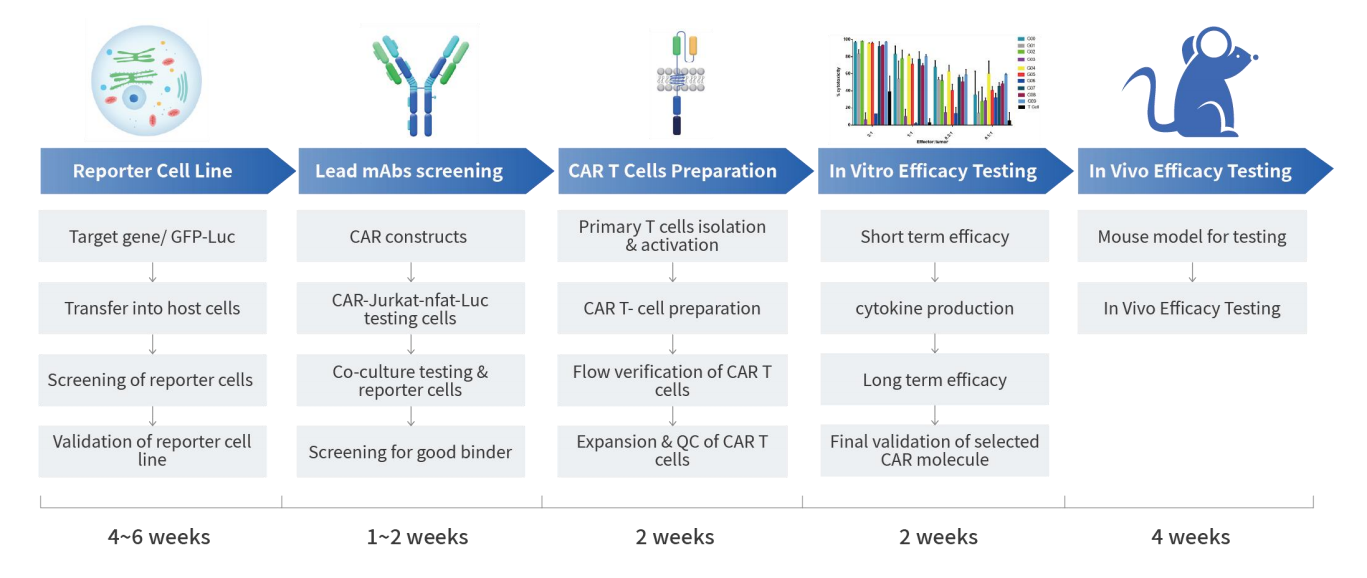
4.2 部分CAR-T体外和体内实验案例展示
- 候选抗体与猴鼠交叉测试
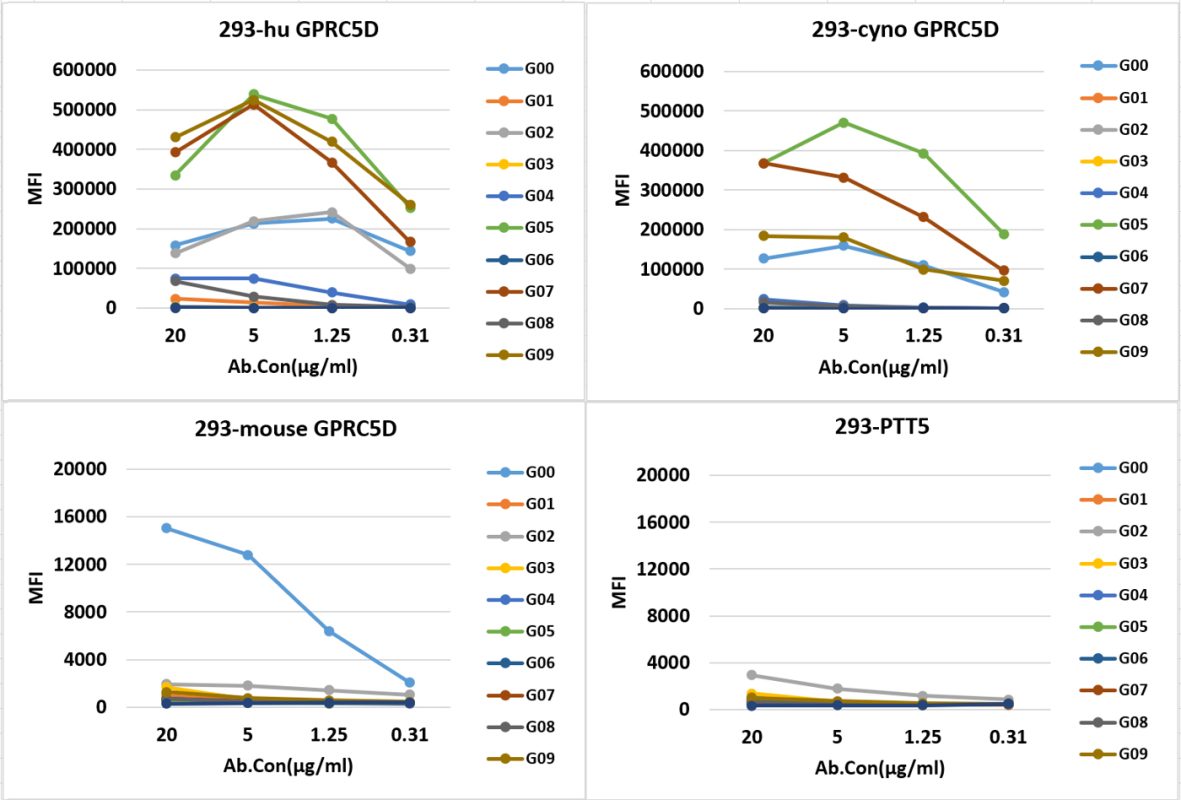
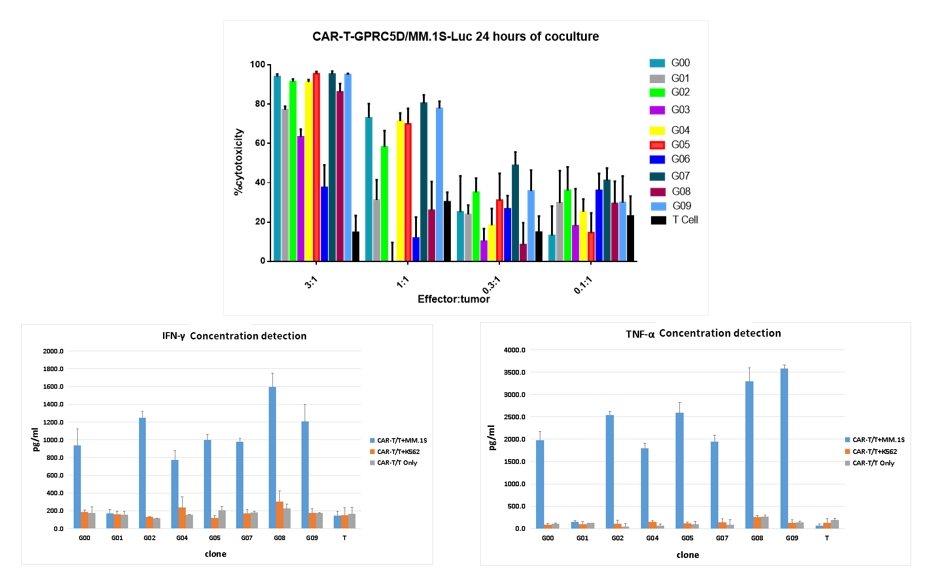
- CAR-T细胞短效杀伤测试与细胞因子(TNF-α、IFN-γ)的分泌检测
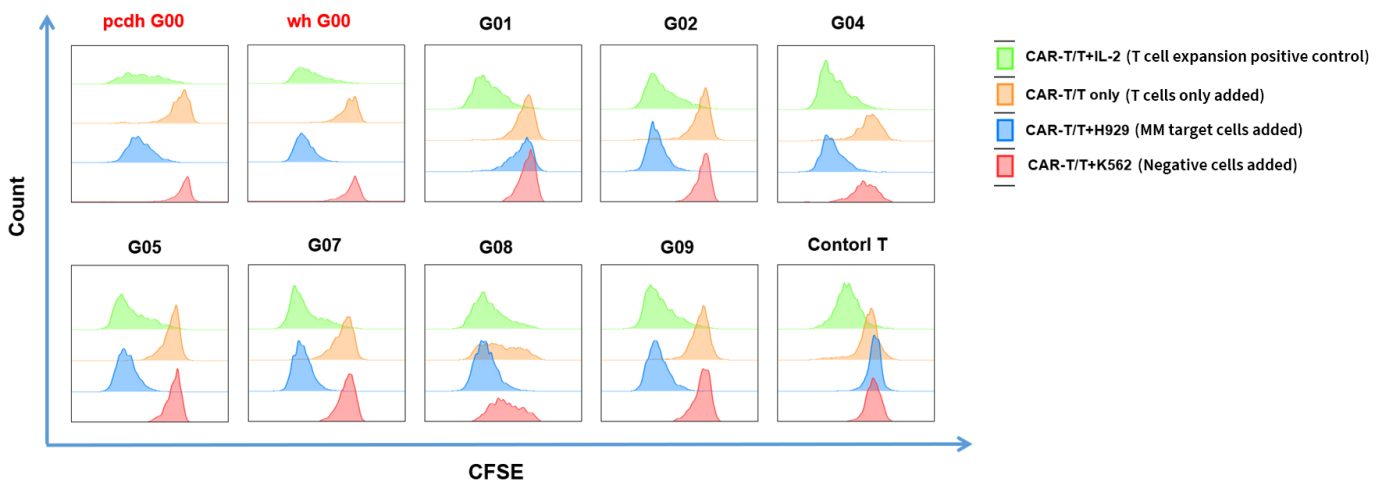
- CAR-T细胞特异性激活与自激活评估
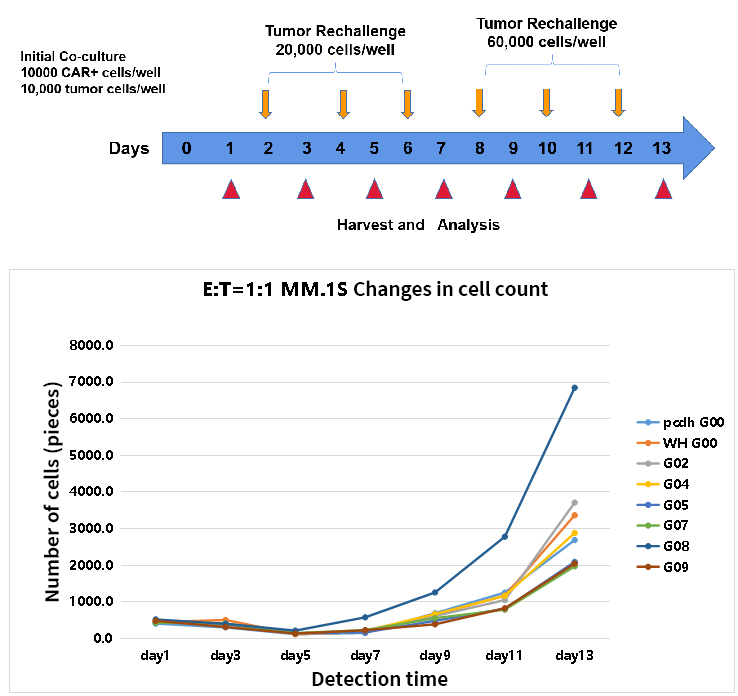
- CAR-T多轮连续杀伤测试
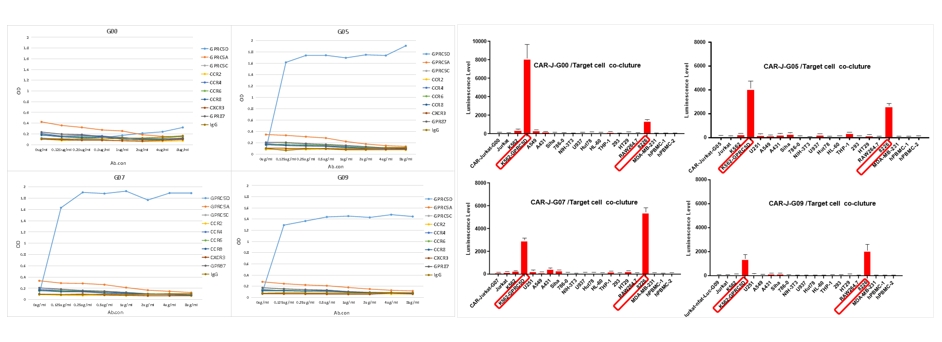
- 候选分子特异性分析
- CAR-T细胞体内动物药效学实验
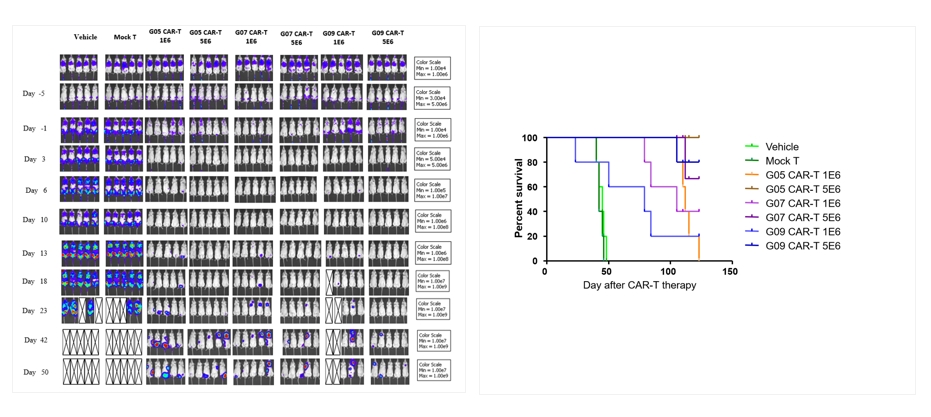
通过体内和体外实验的设定,我们可以筛选CAR分子中的抗体部分是否特异的靶向细胞,使您更加了解靶点的特点、CAR分子的靶向选择性和杀伤机制。
在未来,随着CAR-T疗法的不断发展与优化,以及新的CAR靶点的不断涌现,这一疗法将有望应用于更广泛的肿瘤治疗领域,为患者提供更多的治疗选择。同时,科学家和研究人员将继续努力解决CAR-T疗法在治疗过程中可能出现的副作用和挑战,以不断改善这一治疗方法。
参考文献:
[1] Mchayleh W, Bedi P, Sehgal R, Solh M. Chimeric Antigen Receptor T-Cells: The Future is Now. J Clin Med. 2019 Feb 7;8(2):207.
[2] Hughes-Parry HE, Cross RS, Jenkins MR. The Evolving Protein Engineering in the Design of Chimeric Antigen Receptor T Cells. Int J Mol Sci. 2019 Dec 27;21(1):204.
[3] Mitra A, Barua A, Huang L, Ganguly S, Feng Q, He B. From bench to bedside: the history and progress of CAR T cell therapy. Front Immunol. 2023 May 15;14:1188049.



