1986年,美国FDA批准了世界上首个单抗治疗性药物—Orthoclone(抗CD3单抗OKT3)进入市场,用于器官移植时的抗排斥反应,从此抗体药的研发越来越受到青睐,使其逐渐成为现代生物医药家族中的重要成员。截至2023年1月末,FDA(美国食品药品监督管理局)已累计批准了119款治疗性抗体新药,而这个数字还在持续的增长。根据Precedence Research 姊妹公司 Towards Healthcare 发表的一项研究,预计到2028年,全球抗体药市场收入将达到 4123.6 亿美元左右,显示出抗体药物市场巨大的发展潜力和市场空间。目前,单抗药物的研发技术日益走向成熟,其中通过展示平台实现文库系统的表达和目标分子的筛选是单抗药物研发过程中获取高质量抗体分子的重要手段。抗体的展示平台众多,包括但不限于噬菌体展示、酵母菌展示、核糖体展示及哺乳动物细胞展示等等,其中哺乳动物细胞展示系统凭借独特的优势,正在引起越来越多的重视。那么什么是哺乳动物细胞表面展示技术?与其他体外抗体文库构建系统相比,它的优势体现在哪里?除了抗体分子筛选,是否还有其它方面的应用?本文将带您了解相关内容。
1、哺乳动物细胞表面展示技术的发展
标志着哺乳动物细胞表面展示技术的成功建立是在2008年,Roger R. Beerli等人利用辛德毕斯(Sindbis)病毒表达系统构建了哺乳动物细胞表面展示抗体库,并利用该展示文库顺利完成多个抗体的筛选。在该项研究中,研究者直接从志愿者的外周血单核细胞(PBMC)中分离具有特异性抗体的B细胞,获得抗体的基因序列,利用重组DNA技术构建单链抗体cDNA库(scFv),将其连接到高滴度的Sindbis病毒载体中,该载体中包含表达抗体的信号肽和能够使抗体固定在膜上的跨膜区(TM)。通过载体病毒感染BHK细胞,在BHK细胞膜上展示抗体并进行筛选。该方法可以将抗体以完整IgG或Fab片段的形式展示抗体,并允许通过单次FACS分离特异性抗体,最终从阳性克隆中分离出的重链和轻链的可变区序列 [2]。这些技术的发展使得研究者们能够更有效获得具有特定功能的抗体,为药物研发和临床治疗提供了更多的可能性。
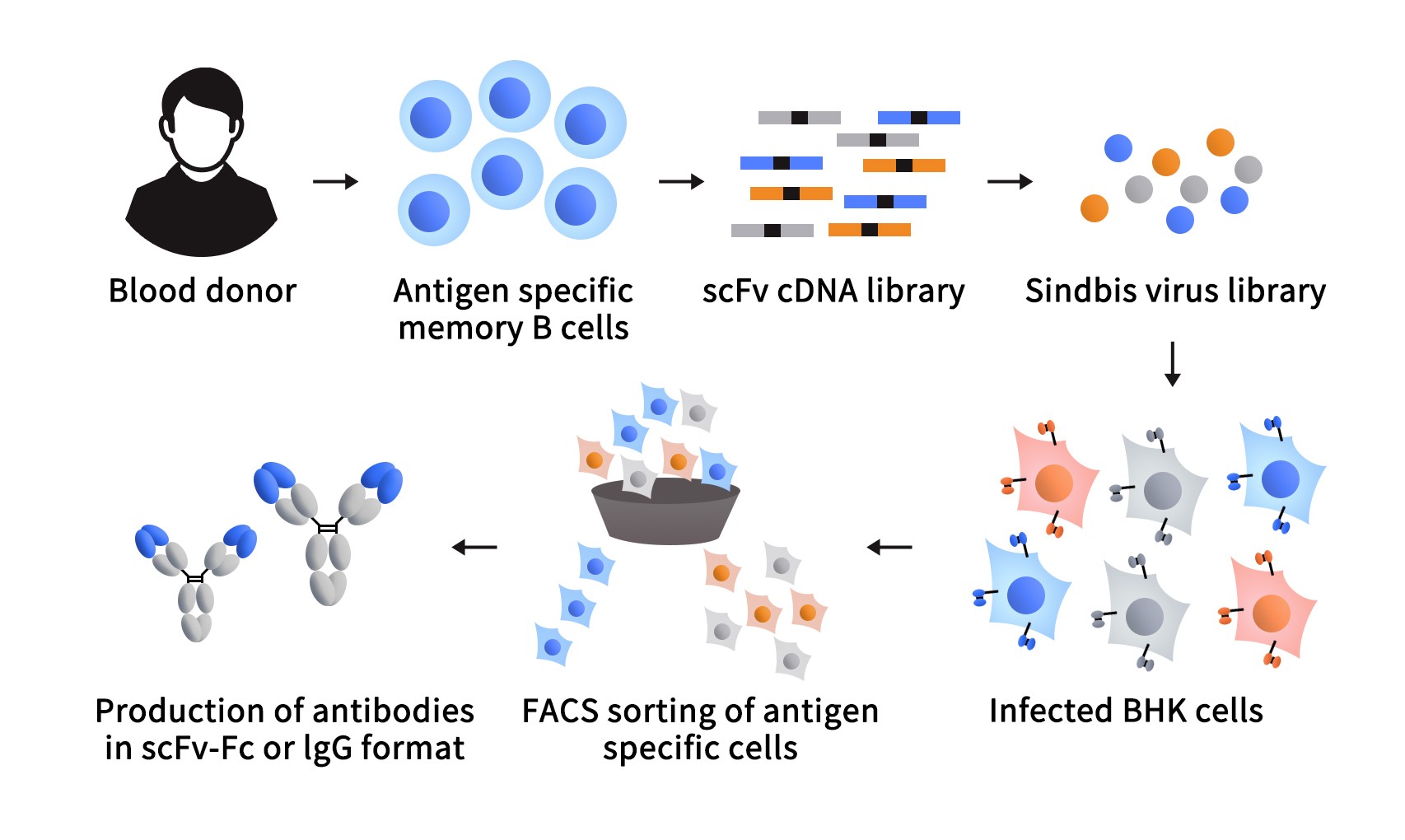
图1 利用辛德毕斯病毒构建哺乳动物细胞展示系统 [1]
2012年,Li等人以乙肝病毒特异性轻链抗体库和重链抗体库为基础,通过哺乳动物细胞表面抗体展示技术构建二级抗体库,成功筛选到乙肝病毒表面抗原特异性的抗体,这项研究为乙肝病毒的治疗和预防提供了新的希望[2]。
2、哺乳动物细胞展示技术的原理
哺乳动物细胞表面展示技术指的是应用重组DNA技术将待展示基因序列与哺乳动物细胞受体跨膜序列融合表达,利用受体跨膜区的膜定位作用将过表达的重组外源蛋白展示在哺乳动物细胞表面。以哺乳动物细胞抗体展示技术为例,该技术主要利用细胞表面表达抗体来筛选并获取重组治疗性单克隆抗体,步骤包含构建载体、转染细胞、表达抗原表位及抗原识别。前两步可以统称为构建哺乳动物细胞表面展示抗体库,最后一步又称为与靶标特异性结合抗体的富集与筛选。在哺乳动物细胞展示技术中,以中国仓鼠卵巢(CHO)细胞和人胚胎肾脏293(HEK293)细胞两个哺乳动物表达系统应用最为广泛。目前筛选出的适合这些表达系统的载体包括pcDNA系列载体、pDGB载体和部分病毒载体。
3、哺乳动物细胞展示技术优劣势
随着细胞展示技术的发展, 细胞展示系统已从最初的原核展示系统扩展到真核展示系统。其中噬菌体展示系统是原核细胞展示系统的代表,也是最早开发、应用最广泛的一类展示技术。酵母展示系统和哺乳动物细胞展示系统是真核展示系统的代表。每种展示系统都有各自的优缺点。与其他展示系统相比,哺乳动物细胞展示系统在抗体药开发中具有显著优势。它的表达系统与人体的最为相似,能够指导蛋白翻译后的正确折叠,提供复杂的翻译后加工修饰,所以哺乳动物细胞展示技术表达的产物在分子结构和生物学功能方面更能接近于天然的高等生物蛋白分子。但是哺乳动物细胞的增殖速度较微生物慢,并且通过哺乳动物细胞展示平台构建的展示库容低于噬菌体或者酵母菌展示平台,因此哺乳动物细胞展示平台不适合于进行特别大通量的非免疫库筛选。下表中对比了噬菌体展示系统与哺乳动物细胞展示系统的部分特性:
| 噬菌体展示系统 | 哺乳动物细胞展示系统 | |
|---|---|---|
| 真核or原核 | 原核 | 真核 |
| 抗体展示形式 | ScFv & Fab | IgG & ScFv & Fab |
| 翻译后修饰 | 无 | 有 |
| 生产周期 | 短 | 长 |
| 库容量 | >10^10 | 10^6-10^8 |
| 生产成本 | 低 | 高 |
| 制备工艺 | 简单 | 复杂 |
与哺乳动物细胞展示技术相比,利用噬菌体展示技术表达外源蛋白或多肽时,外源蛋白或多肽与衣壳蛋白融合表达时存在无法预测的偏差。此外,被展示的外源蛋白或多肽分子量不能太大,否则会影响噬菌体的装配,从而降低它感染宿主的能力。
同为真核表达系统的酵母菌展示系统也存在一些限制。首先,酵母菌展示系统只能展示特定类型的外源蛋白,而不是任何外源蛋白都可以展示。此外,酵母菌在表达外源蛋白时存在过度糖基化的可能性,所以只能用来生产不含糖基化位点的功能性蛋白,限制了其应用范围。而且,酵母菌表达系统中蛋白质后加工过程与哺乳动物细胞差异较大,不能像哺乳动物细胞表达系统那样最大程度还原靶标蛋白的天然状态。此外,酵母菌的遗传稳定性差,在传代过程中容易丢失,从而造成难以重现的实验结果。
4、哺乳动物细胞展示技术的应用
由于哺乳动物细胞展示技术具有翻译后修饰及表达糖蛋白的明显优势,可有效解决原核细胞表达系统中出现的问题,它不仅能够展示全长抗体,还能够利用真核表达系统指导蛋白质的正确折叠,提供复杂的N型糖基化和准确的O型糖基化等多种翻译后修饰,通过该表达系统所合成的蛋白质在分子结构和生化特性方面与人类存具有极高的相似度。所以,哺乳动物细胞展示技术不仅可以应用于抗体药物研发、多肽药物研发等,还可以在疫苗研发、生物治疗和诊断等领域中发挥作用。 除了抗体筛选,哺乳动物细胞表面展示技术还可以在其他许多方面应用。例如,它可以用于研究疾病的发生机制和信号通路,帮助科学家深入理解疾病的病理生理过程。此外,该技术还可以用于开发新型药物靶点、疾病诊断标记物的鉴定和筛选等。 通过哺乳动物细胞表面展示技术构建和筛选重组治疗性单克隆抗体的研究,为生物医药领域的进一步发展和创新提供了重要的平台。对于疾病治疗和药物开发来说,这项技术的应用潜力巨大,将为人类健康带来更多的福祉。
5、缔码生物基于哺乳动物细胞表面展示技术的技术平台
应用动物免疫开发治疗性抗体是最为有效的方案,但是未经改造的动物来源抗体不能用于临床。抗体人源化改造是抗体药开发的必须阶段。缔码生物致力于提供可成药靶点临床前研发产品和服务,旨在让药企跨过单抗平台建立和先导抗体分子筛选的门槛,聚焦于药靶生物学机制和可成药性研究,加速临床管线推进。为此,缔码生物科技搭建了基于哺乳动物细胞展示系统的抗体工程平台(DiLibraryTM),该平台可用于抗体的深度人源化改造(人源化的同时实现亲和力的提升)、抗体亲和力成熟、纳米抗体和TCR的工程改造,以及犬源化和猫源化等其他种源的抗体改造。
- 服务流程
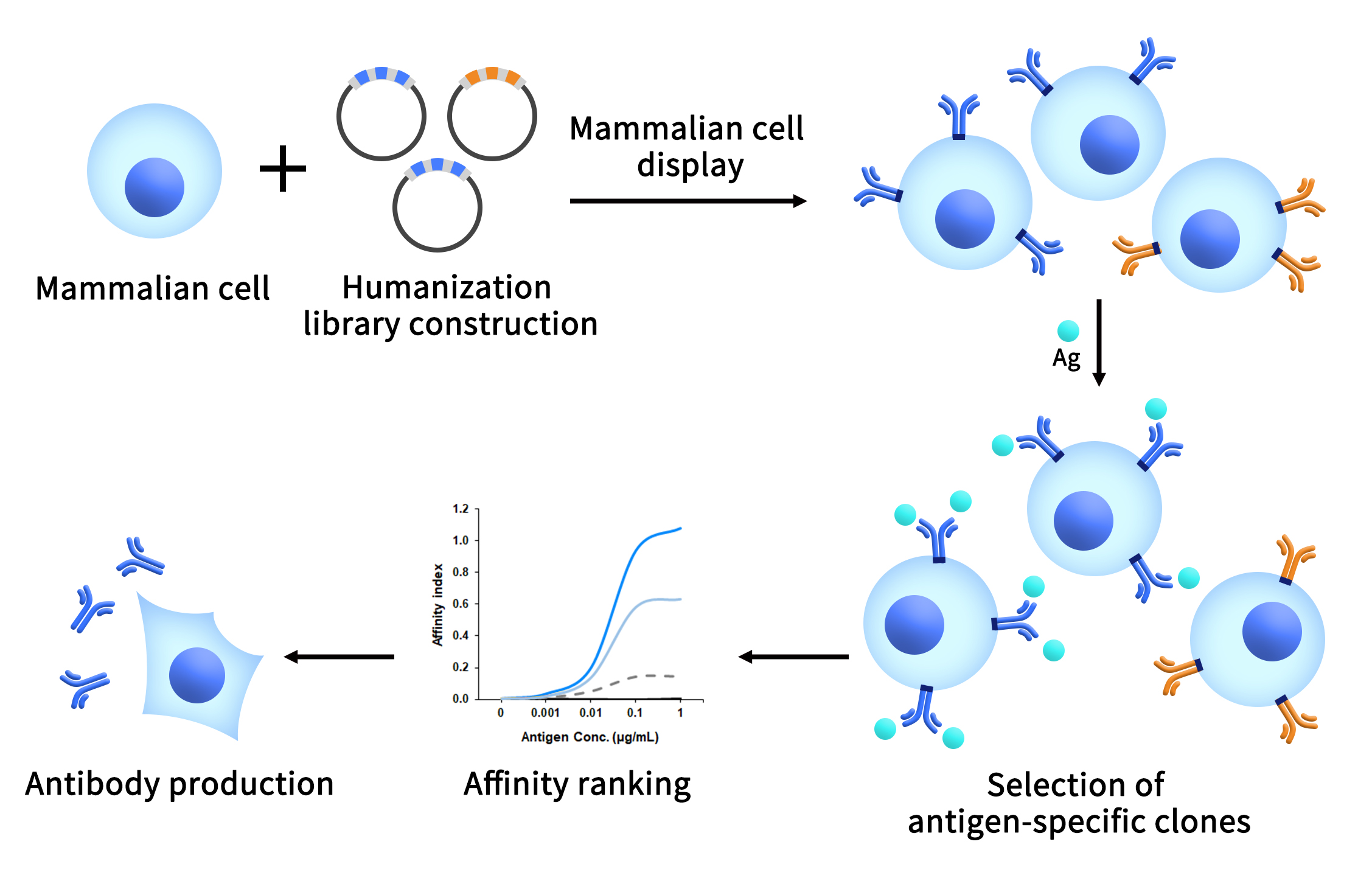
图2 缔码抗体工程平台服务流程
-
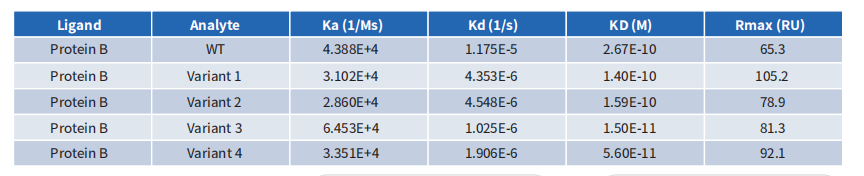
BCMA抗体深度人源化案例展示
采用缔码生物科技DiLibraryTM人源化抗体库进行筛选后,我们获得了比母本嵌合抗体亲和力更高的克隆。亲和力提升到pM级别。
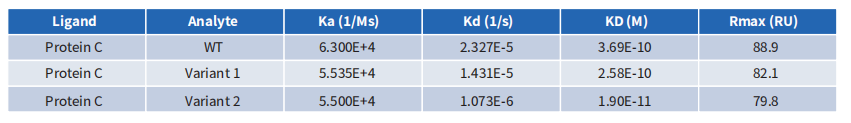
- CEACAM5抗体深度人源化案例展示
采用常规计算机辅助设计进行人源化,CEACAM5抗体亲和力完全丢失;采用缔码生物科技DiLibraryTM人源化抗体库进行筛选后,获得比嵌合抗体亲和力更高的克隆。
-
CCR8抗体亲和力成熟案例展示
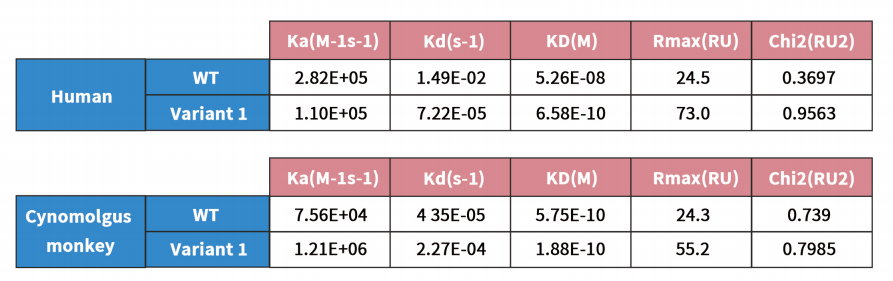
该案例中的anti-CCR8抗体具有人猴交叉属性,针对该分子的LCDR3和HCDR3各突变一个氨基酸,即特异性地将对人源CCR8的亲和力提高了约100倍,而不影响对猴源CCR8的亲和力。
此外,作为一个专业聚焦于抗体药临床前开发公司,缔码生物在开发高质量先导分子的上下游进行了深度布局。为了获得高质量最为天然构象的多穿膜蛋白抗体,我们还搭建了基于哺乳动物细胞表达系统的多穿膜蛋白抗原制备平台(DiMPro),该平台充分利用哺乳动物细胞表达系统优势,可制备生产全长功能性多穿膜蛋白,最大程度的保证重组蛋白的天然构象,点击查看更多详情>>
参考文献:
【1】Beerli RR, Bauer M, Buser RB, Gwerder M, Muntwiler S, Maurer P, Saudan P, Bachmann MF. Isolation of human monoclonal antibodies by mammalian cell display. Proc Natl Acad Sci U S A. 2008 Sep 23;105(38):14336-41.
【2】Li CZ, Liang ZK,Chen ZR,et al. Identification of HBsAg-specificantibodies from a mammalian cell displayed full-length humanantibody library of healthy immunized donor [J]. Cell MolImmunol, 2012,9(2):184-90.



