膜蛋白是生命活动中至关重要的分子,承担信号转导、物质运输和细胞识别等关键功能。随着药物研发和结构生物学研究的深入,膜蛋白已成为新药靶点挖掘与机制研究的核心对象。然而,由于其结构复杂、稳定性差,膜蛋白的表达与纯化仍是科研界的难点。这一需求也推动了专业膜蛋白生产厂家与高品质膜蛋白制备服务的快速发展。
1. 膜蛋白:生命活动的信号之门
膜蛋白是细胞膜的核心组成部分,负责信号传递、分子运输与细胞通讯,被誉为生命活动的“信号之门”。在生物医药研究中,膜蛋白因直接参与细胞信号调控与药物结合,是药物发现与疾病研究中最具价值的靶点之一。据统计,超过60%的上市药物靶点为膜蛋白[1],涵盖了GPCR、离子通道、转运蛋白等多个重要家族。膜蛋白的特殊性在于其功能依赖于三维结构和脂膜环境,这使得其在体外研究、蛋白表达及稳定化过程中面临极大挑战。科研人员往往需要在保持天然构象的同时,实现高纯度、高活性的表达产物,这对实验体系的稳定性和技术积累提出了更高要求。
2. 膜蛋白的类型与功能
膜蛋白是细胞膜的重要组成部分,根据其与膜的结合方式和结构特征,可分为两大类:整合型膜蛋白(Integral Membrane Proteins)和外周型膜蛋白(Peripheral Membrane Proteins)。整合型膜蛋白通常穿越脂双层,含有一个或多个跨膜结构域,是信号传导、物质运输和受体识别的核心执行者;外周型膜蛋白则附着于膜表面,通过与脂质或整合蛋白相互作用参与信号复合体的形成、细胞骨架连接以及膜蛋白调控 [2]。
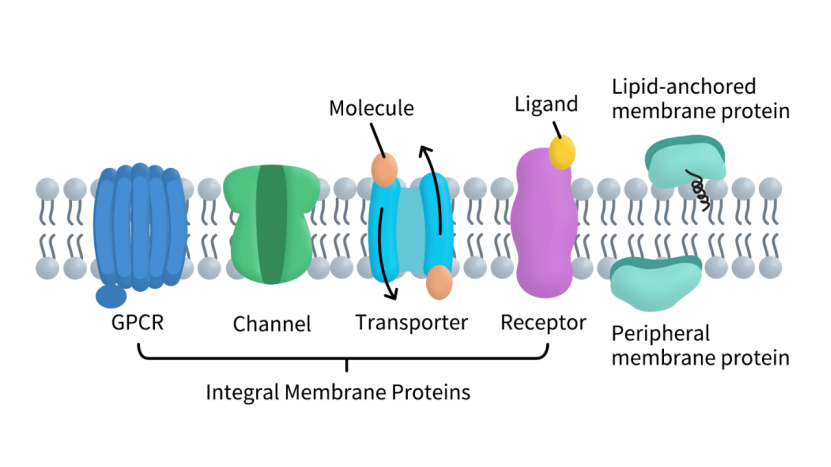
Figure 1. The Types of Membrane Proteins.
在整合型膜蛋白中,有三个功能家族在科研和药物开发中尤为关键。首先是G蛋白偶联受体(GPCRs),这类蛋白可感知多种外部信号,如激素、神经递质和光信号,并将信息传递到细胞内部,调控免疫、神经、代谢及心血管等多种生理功能。GPCR也是药物开发的核心靶点,约占已批准药物靶点的三分之一。其次是离子通道(Ion Channels),通过调控钠、钾、钙等离子跨膜流动,参与神经信号传递、肌肉收缩和心律调控,广泛用于心血管疾病和神经疾病的研究与药物筛选。最后是转运蛋白(Transporters),其主要负责物质和离子的跨膜转运,维持细胞稳态,对药物吸收、分布和外排机制有直接影响,是研究耐药性和代谢性疾病的重要靶点。
外周型膜蛋白虽然不穿膜,但在细胞信号调控中同样不可或缺。例如,它们可作为信号复合物的调节因子或骨架蛋白连接点,在受体激活、信号传递及膜蛋白定位中起到关键作用。
3. 膜蛋白在科研与药物开发中的应用
膜蛋白不仅是基础研究的核心对象,也是现代药物开发不可或缺的靶点:
- 抗体药物研发
多数抗体药物靶点位于细胞膜表面,如免疫检查点蛋白PD-1、PD-L1、CTLA-4,以及在肿瘤治疗中极具价值的HER2、EGFR、Claudin18.2、TROP2等。其中许多为多跨膜结构蛋白,天然构象对抗体结合至关重要,因此需要高活性、高纯度的膜蛋白作为免疫原、筛选材料或功能验证工具。此外,血液肿瘤领域常见靶点如CD20、CD19、CD22,免疫调控靶点如OX40、4-1BB、CD47、SIRPα,以及炎症和病毒相关靶点如CCR5、CXCR4 等,均依赖稳定的膜蛋白样品进行抗体筛选和亲和力验证。
- 小分子药物筛选
GPCR、离子通道、转运蛋白等膜蛋白是最重要的小分子药物靶点,但其疏水性强、对膜环境高度依赖,传统去垢剂体系常导致构象改变,从而影响结合实验结果。Nanodisc 技术通过将膜蛋白重新嵌入类天然脂质双层中,使其以最接近生理状态的形式存在,因而广泛应用于小分子高通量筛选(HTS)、配体结合动力学研究、药物结合口袋解析及GPCR-配体耦合机制研究。更多关于Nanodisc在膜蛋白中的应用>>
Nanodisc 尤其适用于β2AR、CCR5、CXCR4、A2A 受体等典型 GPCR,以及 TRP 通道、钠/钾/钙离子通道等靶点,使小分子药物筛选更加准确和可重复,是近年来膜蛋白药物发现的重要技术趋势。更多关于Nanodisc膜蛋白解决方案>>
- 结构生物学与机制研究
膜蛋白是结构生物学领域的重点研究对象。随着冷冻电镜(Cryo-EM)的迅速发展,GPCR、转运蛋白、离子通道等多跨膜靶点的高分辨率结构逐渐被解析。然而,这些研究极度依赖高纯度、稳定构象的膜蛋白样品。除了Cryo-EM,膜蛋白还广泛用于SPR/BLI、微量热泳动(MST)、脂质重构平台和复合物组装分析(如GPCR-G 蛋白复合物、离子通道调控复合物等)。其中,分析蛋白-蛋白或蛋白主要用于小分子相互作用;微量热泳动是用于测定膜蛋白-配体结合常数;脂质重构平台主要是研究膜环境对蛋白活性的调控。
与Cryo-EM一样,这些应用对膜蛋白样品质量要求极高。只有高质量膜蛋白样品,才能使研究者能够深入理解信号通路机制、药物结合模式及激活构象变化,从而推动结构驱动药物设计(SBDD)的加速发展。这些应用场景凸显了科研机构和药企对高质量膜蛋白表达与制备服务的迫切需求,为后续解决方案提供了明确的背景。
4. 膜蛋白研究中的核心挑战与解决思路
膜蛋白在药物开发和生命科学研究中具有不可替代的重要性,但其研究和制备过程中仍存在多重挑战。首先,膜蛋白结构复杂,多跨膜螺旋和疏水区域使其在体外表达时易产生折叠错误或聚集,导致活性丧失。其次,天然膜环境对膜蛋白功能至关重要,传统可溶性蛋白表达体系往往无法模拟脂双层环境,使蛋白稳定性和生物活性难以保证。此外,膜蛋白的表达水平普遍较低,纯化过程复杂,易受到去垢剂和溶液条件影响,从而降低产率和实验可重复性。这些问题不仅增加了实验成本,也延缓了科研进程和药物开发进度。所以,如何在保持天然构象的前提下获得高质量样品,成为膜蛋白研究的核心挑战。
针对这些挑战,科研团队和药企通常采取多种策略。包括选择适合的宿主表达系统(如哺乳动物细胞或昆虫细胞)以获得正确翻译后修饰;通过优化基因序列和表达条件提高产量;结合去垢剂筛选、纳米盘(Nanodisc)或脂质体重构等技术保持膜蛋白天然构象;并建立严格的质量控制体系进行活性验证和结构检测。但这也需要长时间的摸索,而借助专业的膜蛋白制备服务,研究人员可以显著提升膜蛋白表达与纯化的成功率,获得稳定、高活性且可重复的实验材料,为抗体药物筛选、小分子药物开发和结构生物学研究提供可靠保障。
在这些行业通用策略不断发展的过程中,越来越多的研究机构开始探索将多种技术整合为体系化、可复用的膜蛋白制备流程,以减少试错成本并提升跨项目的一致性。其中,采用哺乳动物细胞表达 + 纳米盘(Nanodisc)重构的组合方案逐渐成为趋势,它既能保持天然构象,又能兼容更复杂的GPCR、离子通道等多跨膜靶点。
5. 缔码生物:专业膜蛋白制备解决方案
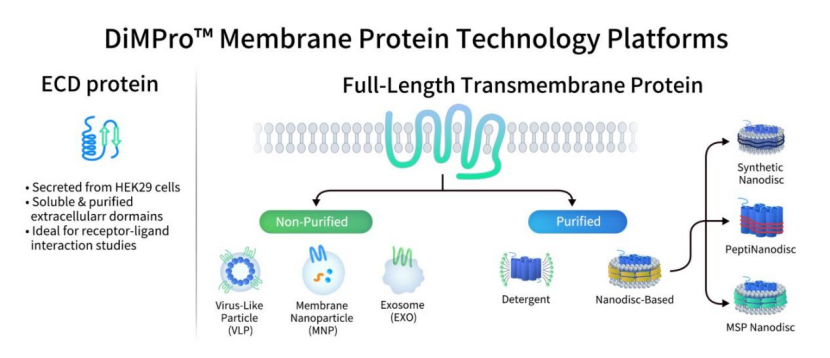
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。既然聚焦可成药靶点,那膜蛋白,尤其是多穿膜蛋白的制备难点与挑战是缔码人不得不翻越的山。也正是基于这些挑战和应用需求,缔码生物经过长时间的摸索,成功搭建了基于哺乳动物细胞表达的DiMPro™功能性膜蛋白开发平台。该平台专注于膜蛋白,尤其是多跨膜蛋白的制备,旨在为抗体药物与小分子药物研发提供高质量的膜蛋白表达与制备解决方案。对于单穿膜蛋白,主要采取胞外结构域(ECD)融合蛋白表达系统。而针对全长多穿膜蛋白,如GPCR和Claudin系列蛋白,则采用缔码七大全长多跨膜蛋白表达平台,包括纯化膜蛋白平台和非纯化膜蛋白平台。纯化膜蛋白平台包括:Synthetic Nanodisc、MSP Nanodisc、PeptiNanodisc和去垢剂平台。非纯化膜蛋白平台包括:MNP(纳米膜颗粒)、VLP和外泌体平台。
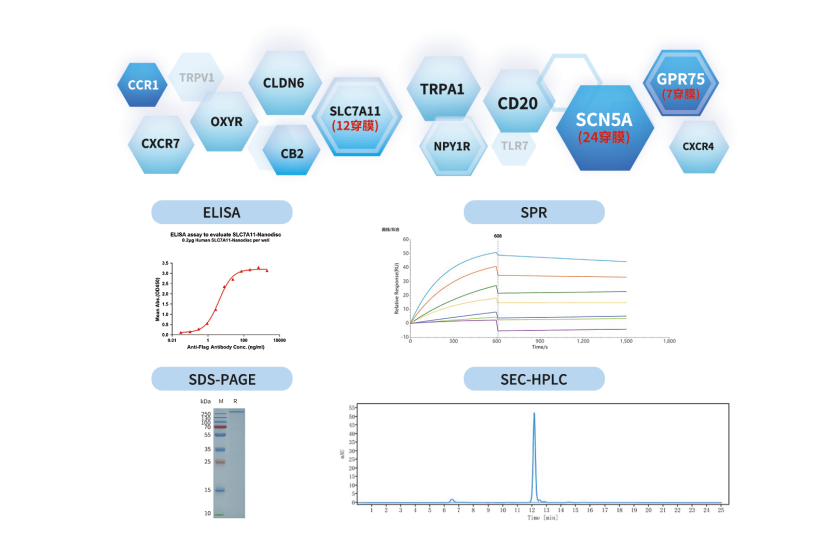
缔码生物凭借成熟的膜蛋白表达平台与丰富的项目经验,现已制备出900+全长膜蛋白,覆盖GPCR、离子通道等热门药靶家族700+靶点,最高穿膜次数可达24次。同时,缔码生物针对膜蛋白制定了严格的质量控制体系,会通过SDS-PAGE、SEC-MALS、活性检测等多维度检测,确保膜蛋白结构完整与生物学活性。
参考文献:
[1] Overington JP, et al. How many drug targets are there? Nat Rev Drug Discov. 2006.[2] Lodish H, et al. Molecular Cell Biology. 9th edition, W.H. Freeman, 2021.
[3] Carpenter EP, et al. Overcoming the challenges of membrane protein crystallography. Curr Opin Struct Biol. 2008.


