近年来,在抗体药物和生物药开发领域,纳米抗体(Nanobody)因其独特的结构与生物学特性迅速成为热门研究方向。这类来源于骆驼科动物的单域抗体(VHH, single-domain antibodies)具有体积小、稳定性强、易工程化等优势,适用于药物研发、诊断检测、成像、免疫治疗等多个领域。伴随纳米抗体从基础研究走向临床验证与商业化,产业界对高质量纳米抗体、纳米抗体定制服务与可立即使用的现货纳米抗体的需求不断增长。纳米抗体从学术发现到临床转化的 30 年历程,已从概念验证走向产业化与药品上市,为生物药开发提供了新思路与工具。
1. 纳米抗体的发现:单域抗体的起点
纳米抗体(Nanobody,又称单域抗体,VHH)的发现始于1993年。当时,科学家在骆驼科动物血清中发现了一类不同于传统 IgG 抗体的天然抗体,这类抗体仅由重链组成,缺失轻链,但仍能特异性结合抗原 [1]。这一发现颠覆了长期以来的认知:科学界普遍认为,抗体必须由重链和轻链共同形成抗原结合位点才能正常发挥功能,而骆驼科动物的重链抗体证明了单个可变重链结构域(VHH)也能独立识别抗原。随后,研究者在羊驼、美洲驼等多种骆驼科动物中进一步确认了这种天然存在的重链抗体,并建立了从免疫动物获取 VHH 的方法。这一发现不仅为抗体科学提供了新的研究方向,也为后续的纳米抗体制备和工程化奠定了基础。同时,它开启了科研界对单域抗体潜在应用价值的系统研究,从基础免疫学到药物研发,纳米抗体逐渐成为重要的研究对象。纳米抗体的发现过程体现了科学研究中从偶然观察到系统探索的典型路径,也标志着单域抗体研究领域的正式起点,为后续技术发展和应用奠定了坚实的基础。
2. 纳米抗体的结构优势
纳米抗体仅12–15 kDa,纳米抗体由单个可变重链结构域(~12–15 kDa)构成,比传统IgG 抗体小10倍,使其更易进入组织和穿透肿瘤微环境,这也使其应用范围更广、工程弹性更强。
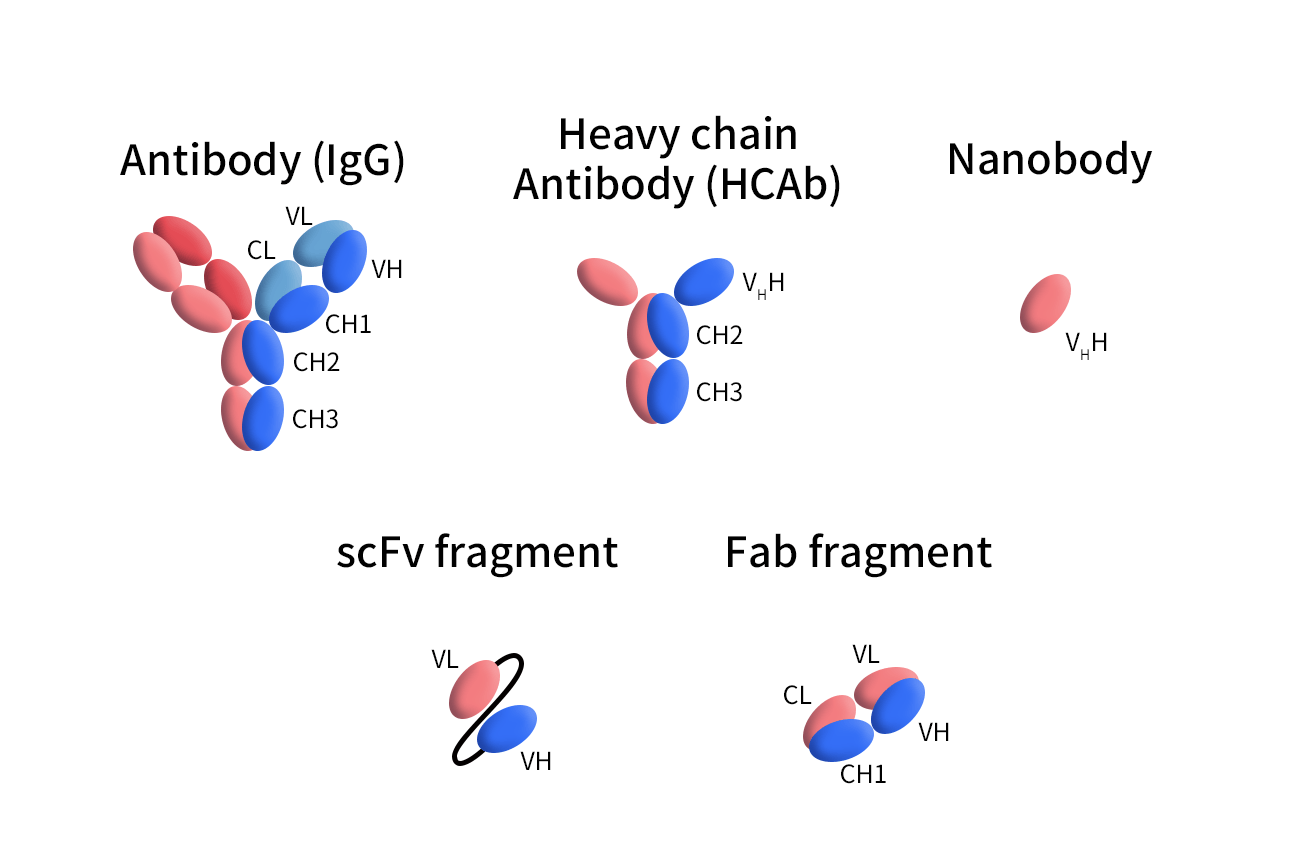
Figure 1. The Structures of different Antibodies
与传统的IgG相比,纳米抗体还具有以下几个特点:
-
高稳定性:可耐高温,在极端pH或有机溶剂中保持结构,便于制剂开发与复杂应用场景;
-
高亲和力与特异性:适用于复杂靶点,包括“难成药”膜蛋白、酶与构象依赖性抗原;
-
易表达、低成本:可在大肠杆菌(E. coli)、酵母(如 Pichia pastoris)、哺乳细胞体系中高效表达,利于放大生产与质量一致性;
-
易工程化:适合构建多价、多特异性分子、Nanobody-Fc、Nanobody-药物偶联物等;
-
高组织穿透力:是实现肿瘤穿透和药物递送热门平台之一。
这些特征使得纳米抗体在药物递送、成像探针与诊断试剂等方面具有天然优势 [2]。
3. 纳米抗体的制备与筛选
纳米抗体的发现仅是起点,将其转化为可用的研究工具或药物分子,需要高效的制备与筛选方法。针对不同抗原和应用需求,科研团队可选择不同方法。对于未知序列的纳米抗体,需要优先对骆驼科动物(羊驼、骆驼、美洲驼)进行抗原免疫,采集外周血构建纳米抗体/VHH文库,然后再选择合适的筛选技术;对于已知序列的纳米抗体,可直接合成文库或生产表达。常用的筛选方法及使用场景如下表所示:

针对于获得序列后纳米抗体的生产与表达,常见表达体系包括:大肠杆菌(cost-effective,适合无糖基化的抗体片段)、酵母(Pichia、Saccharomyces,适合工业发酵)、昆虫细胞与哺乳细胞(用于需要复杂修饰或更接近天然折叠的产品)。近年来,针对高产量、可溶表达和正确折叠的通用策略被不断优化(例如信号肽选择、伴侣蛋白共表达、培养基与发酵条件优化等)[5]。
4. 纳米抗体在生物药开发中的应用
4.1 治疗用途
纳米抗体可作为独立治疗分子(单体或多价串联)用于拮抗或中和病理性蛋白。例如,第一个获得临床批准并进入市场的纳米抗体药物 caplacizumab(商品名 Cablivi®)就是针对 von Willebrand 因子的抗体片段,用于获得性血栓性血小板减少性紫癜(aTTP)的治疗,标志着纳米抗体从研发走向临床成功。在治疗性抗体中,纳米抗体常设计成中和抗体、免疫调节抗体、多价或多特异性抗体及纳米抗体- Fc 融合蛋白。
4.2 抗体-药物偶联(ADC)与靶向递送
纳米抗体因其体积小,所以更易穿透实体肿瘤并把药物或毒素输送至肿瘤微环境,可作为肿瘤靶向配体或与毒素/小分子偶联形成Nanobody-Drug Conjugates。此外,纳米抗体还能与脂质体、纳米颗粒结合用于递送RNA/siRNA/蛋白,提高递送效率与选择性。而且高稳定性也利于在体内长途转运与复杂给药途径(例如吸入或局部给药)。
4.3 医学成像与放射性探针
纳米抗体VHH可以快速清除背景、快速到达目标并能在短时间内获得高对比度图像,特别适合 PET/SPECT/荧光成像等应用;与传统抗体相比,成像时间窗更短、灵敏度高,便于临床影像化与早期诊断(或药效学成像)。
4.4 其他应用
纳米抗体因其易于拼接为双特异或多特异构建体,能同时靶向肿瘤相关抗原与免疫细胞激活通路,可用于设计新一代免疫治疗或与特异/多特异分子设计。此外,在体外诊断(IVD)与快速检测试剂领域中,纳米抗体因其稳定性高且不易失活,非常适合用于快速检测试剂条、ELISA/CLIA试剂、病毒检测和环境/食品检测试剂的开发中,使其具有较好的批次一致性和长期稳定性。
5. 缔码生物“现货型”纳米抗体&定制服务
随着纳米抗体在药物开发与诊断领域的快速发展,缔码生物推出覆盖抗原设计、免疫或体外文库筛选、序列工程化、表达工艺优化及放大生产的全流程纳米抗体定制服务,为科研、诊断与生物药企业提供一站式解决方案。特别值得一提的是,缔码生物正着力推广 “现货型纳米抗体”(Off-the-shelf Nanobodies)——即在常见靶点上建立标准化、质量受控的纳米抗体库存,客户无需等待免疫与筛选周期(通常数周到数月),适合快速验证/替代试验,即可直接测试序列,显著压缩项目早期的交付时间与成本。在现货纳米抗体合作过程中,缔码生物同样延续了其在兔单抗先导序列转让中的核心特色——“零周期、零首付、零风险”模式,使早期研发更加高效、可控。
- 零周期:现货序列可即拿即用,实现当天获取、当天验证,大幅加快早期筛选与替代实验。
- 零首付:无需前期支付定制费用,客户可先验证序列效果,再决定是否进入后续优化与开发环节。
- 零风险:先测试、后投入的合作模式避免了传统流程中“免疫了却不能用”的不确定性,减少研发浪费,显著提升成功率。
在验证现货序列有效后,客户还可进一步委托缔码进行亲和力成熟与序列优化,以满足更高等级的机制研究或临床前开发需求。这种现货型策略不仅压缩周期和成本,也让纳米抗体项目能以更低门槛、更可控的方式快速进入关键验证阶段,加速从概念到可用分子的整体研发进程。
参考文献
- Hamers-Casterman, C., Atarhouch, T., Muyldermans, S. et al. Naturally occurring antibodies devoid of light chains. Nature 363, 446–448 (1993).
- Muyldermans S. Nanobodies: natural single-domain antibodies. Annu Rev Biochem. 2013;82:775-97.
- McMahon C, Baier AS, Pascolutti R, Wegrecki M, Zheng S, Ong JX, Erlandson SC, Hilger D, Rasmussen SGF, Ring AM, Manglik A, Kruse AC. Yeast surface display platform for rapid discovery of conformationally selective nanobodies. Nat Struct Mol Biol. 2018 Mar;25(3):289-296.
- Alexander, E., Leong, K.W. Discovery of nanobodies: a comprehensive review of their applications and potential over the past five years. J Nanobiotechnol 22, 661 (2024).
- Zheng, Y.; Li, B.; Zhao, S.; Liu, J.; Li, D. A Universal Strategy for the Efficient Expression of Nanobodies in Pichia pastoris. Fermentation 2024, 10, 37.


