在过去一年中,CDH3(Cadherin-3,P-cadherin)这一传统意义上的细胞黏附分子,开始频繁出现在肿瘤新药研发与国际学术会议中。以CDH3为靶点的抗体-药物偶联物(ADC)在实体瘤,尤其是非小细胞肺癌(NSCLC)中的早期临床数据,显示出具有潜力的客观缓解信号,引发了产业界与科研界的高度关注。同时,围绕CDH3的双特异性抗体和T细胞重定向治疗策略也已进入临床探索阶段。这些临床进展也预示着CDH3正从“肿瘤相关标志物”逐步转变为具有明确转化潜力的治疗靶点。
一、什么是CDH3?——结构、表达与功能
CDH3基因编码P-钙黏连蛋白(P-cadherin,又称为胎盘钙黏蛋白),属于经典钙依赖型黏附蛋白家族,与E-cadherin(CDH1)和N-cadherin(CDH2)同源,是第三个在小鼠内脏内胚层细胞系PSA5-E中被鉴定和表征的经典钙黏蛋白。该家族蛋白通过介导细胞-细胞之间的钙依赖性同源结合,在组织结构维持和细胞命运调控中发挥关键作用。CDH3基因定位于16q22.1染色体,与CDH1有66%的同源性。
成熟的P-钙黏蛋白糖蛋白分子量为118 kDa,其结构与经典钙黏蛋白相似。它由5个胞外 cadherin重复结构域(EC1-EC5)、单一跨膜区及胞内结构域组成,主要促进同型相互作用(同类型钙黏蛋白之间的相互作用)。其胞内区包含两个主要结构域:近膜结构域(JMD)和连环蛋白结合域(CBD)。其中,JMD在细胞迁移中起着关键作用,而CBD对钙黏蛋白的功能至关重要。α、β、γ和p120连环蛋白是已知的相互作用蛋白。β-连环蛋白(β-ctn)以及γ-连环蛋白是一种参与组织模式形成的信号分子,其活性受CBD、酪氨酸磷酸化和转录因子调控。P120-catenin(P120-ctn)直接与JMD相互作用,并受酪氨酸激酶调控,调节钙黏蛋白的细胞内运输、稳定性、黏附能力和细胞运动性。α-catenin(α-ctn)将钙黏蛋白-catenin连接复合物连接到肌动蛋白细胞骨架并介导信号转导,这是CDH3同时具备“结构蛋白”和“信号调控分子”属性的重要结构基础[1]。
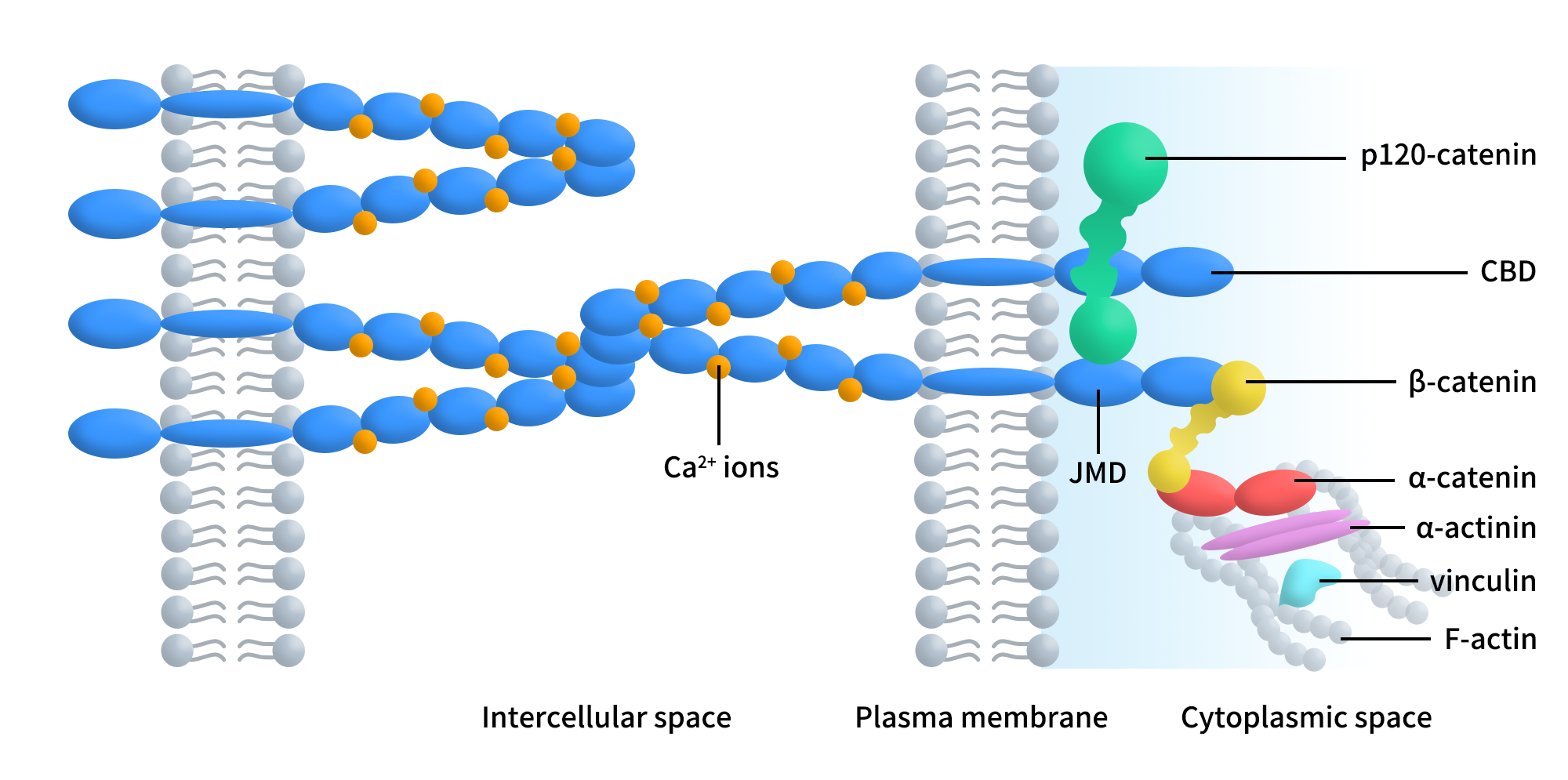
Figure 1. Schematic representation of the classical cadherin-catenin complex.[1]
与CDH1在多种上皮组织中广泛表达不同,CDH3在正常成人组织中表达相对受限,主要见于胎盘滋养层、部分基底上皮细胞及特定发育阶段组织。这种相对受限的表达模式,为其作为肿瘤靶向治疗提供了理论安全窗口。在生理状态下,CDH3主要参与细胞间黏附、组织结构稳定及上皮极性维持,并在胚胎发育与组织分化过程中发挥调控作用。
二、CDH3/P-cadherin在肿瘤细胞中的作用机制
在多种肿瘤中,CDH3并非简单地承担细胞-细胞黏附功能,而是通过异常表达和空间重分布,深度参与肿瘤细胞的侵袭、迁移及恶性进展。与正常上皮组织中以稳定黏附为主的功能不同,肿瘤细胞中的CDH3更像是一个信号放大与整合节点,将黏附状态变化转化为促肿瘤的细胞内信号。
P-cadherin最核心的信号枢纽是其与β-catenin(βctn)和p120-catenin(p120ctn)的互作,这些catenin分子通常稳定黏附连接并将cadherin与细胞骨架连接。在恶性环境下,P-cadherin 可竞争性干扰E-cadherin的肿瘤抑制作用,扰乱E-cadherin/β-catenin及E-cadherin/p120ctn 复合体,从而降低细胞黏附,增强迁移和侵袭能力。
- 在基底样乳腺癌细胞系中,P-cadherin与α6β4整合素互作,促进肿瘤细胞对基底膜成分如 laminin的黏附,同时激活FAK、Src及AKT激酶,提升细胞运动性、侵袭性及存活能力。
- 在卵巢癌中,P-cadherin与β1整合素及胰岛素样生长因子1受体(IGF-1R)共同作用。P-cadherin增强IGF-1R的激活,并影响p120ctn 的磷酸化及胞质定位,从而促进腹膜转移细胞的初始黏附,这对转移扩散至关重要。此外,P-cadherin过表达还增加MMP1和MMP2的分泌及激活,这些基质金属蛋白酶可降解细胞外基质,并将P-cadherin 细胞外结构域切割成可溶片段,该片段具有促进侵袭的作用,这形成一个正向放大机制。
- 在结肠癌模型中,敲低P-cadherin可降低β-catenin水平及其下游靶基因c-Myc和survivin的表达,减少侵袭性和肝转移能力,表明P-cadherin能调控典型信号通路。P-cadherin还通过激活Rac1、Cdc42等小GTP酶,影响细胞骨架动力学,促进细胞运动;在某些情境下,还能增强EGFR和IGF-1R的配体依赖性信号,进一步放大促肿瘤进程。
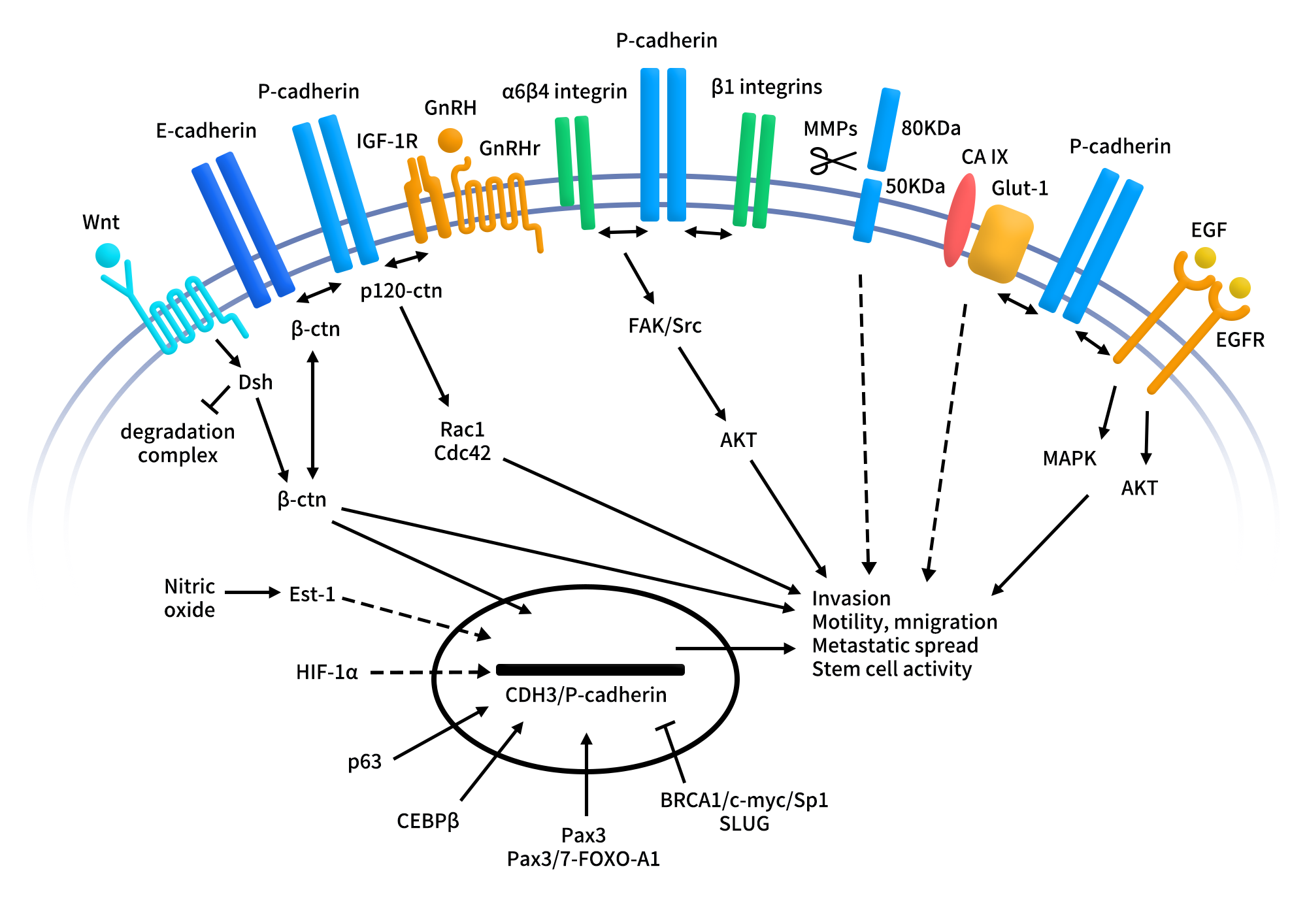
Figure 2. P-cadherin signaling pathways in the malignant setting.[2]
总体而言,P-cadherin的信号网络包括与整合素、受体酪氨酸激酶、小GTP酶以及其他 cadherin家族成员的交叉对话,共同促进肿瘤细胞的侵袭、转移及干性特征,为靶向抑制恶性进展提供了潜在干预点。
三、从肿瘤机制看CDH3的靶向价值与策略意义
前述研究显示,CDH3在肿瘤细胞中已不再是单纯的细胞-细胞黏附分子,而是通过与integrin、Src/FAK/AKT、小GTPase以及多种膜受体信号的交叉作用,放大促侵袭、迁移和转移相关的信号网络[2]。这一功能转变,与其在多种恶性肿瘤中的异常表达状态密切相关,也构成其潜在靶向价值的生物学基础。
- 在病理与分子分型层面,CDH3在基底样乳腺癌、卵巢癌、肺癌及部分消化道肿瘤中常呈显著上调,并与高分级、侵袭性增强及不良预后相关[3]。值得注意的是,其表达并非均匀分布,而更倾向于富集于肿瘤侵袭前沿或呈现EMT/集体迁移特征的细胞群体。这一“侵袭相关表达模式”提示,CDH3的上调并非偶发事件,而是肿瘤细胞在微环境选择压力下,对迁移能力和信号可塑性需求增加的适应性结果。
- 从药物开发角度看,CDH3的表达特征与空间定位共同赋予其较高的成药潜力。其稳定定位于细胞膜表面,胞外cadherin重复结构域高度可及,使其成为抗体类药物理想的识别与递送靶点;同时,其在正常成人组织中的表达相对受限,为肿瘤选择性干预提供了潜在治疗窗口[4]。然而,机制研究亦表明,CDH3并非典型的驱动性致癌基因,而更像是侵袭与转移信号网络中的功能放大器和协同节点。因此,单纯抑制其信号功能本身未必足以显著抑制肿瘤生长,但其作为靶向“定位分子”的价值却十分突出。
基于上述认识,当前 CDH3 的靶向策略更多聚焦于抗体-药物偶联物(ADC)、双特异性抗体或与其他靶向及免疫治疗的联合应用,利用其在肿瘤细胞表面的表达优势,实现高效、选择性的治疗递送。与此同时,围绕CDH3表达水平、空间分布特征及其与侵袭性表型之间的关系进行患者分层,也被认为是推动其临床转化成功的关键前提。
四、CDH3的临床研究进展
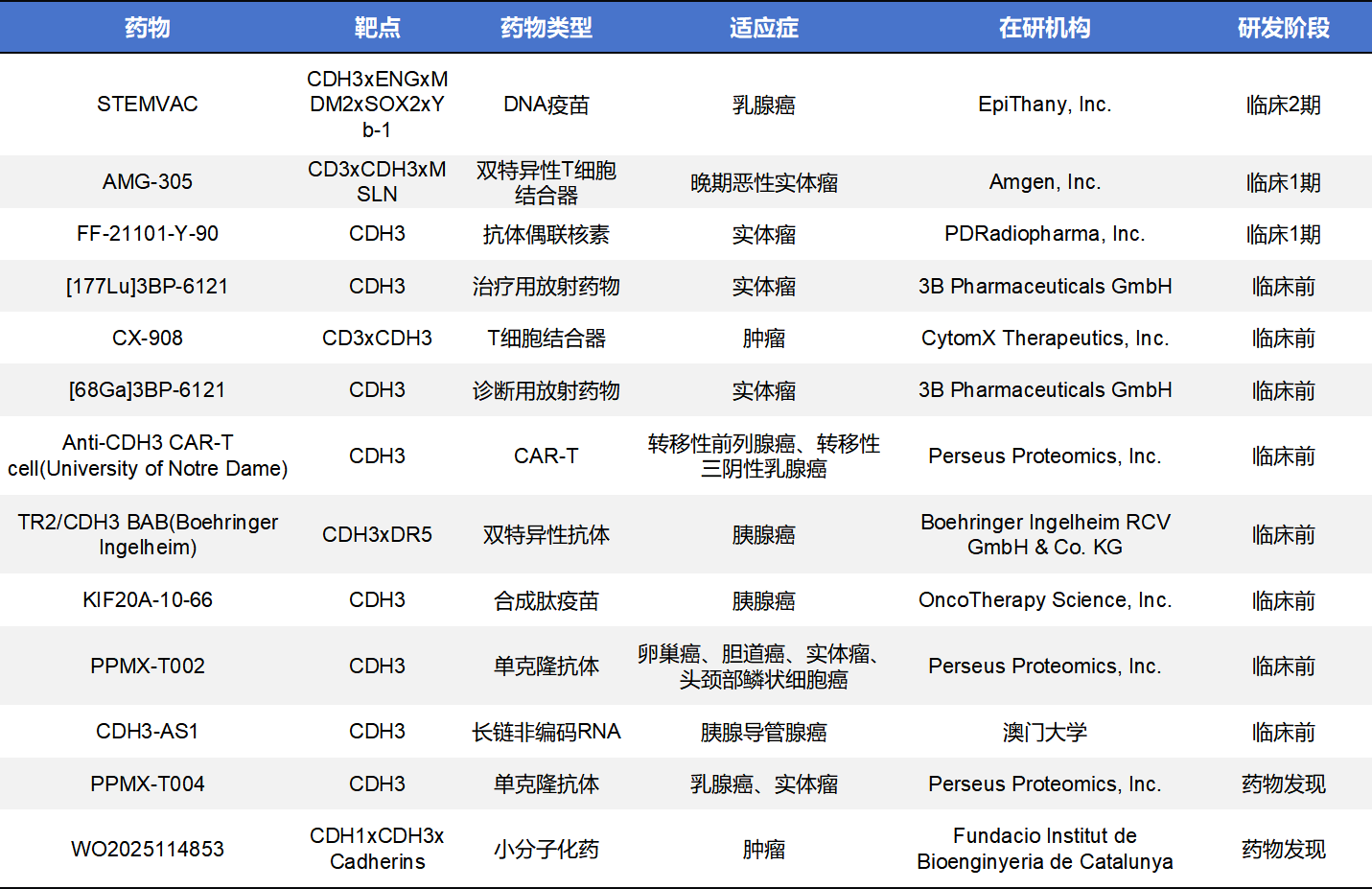
目前,针对CDH3(P-cadherin)的靶向药物正逐步进入临床开发阶段。不完全统计,全球范围内约有26款在研药,其中进入临床的有4款,处于临床前的有12款。处于活跃状态的在研药以ADC药物居多。
4.1 CDH3 ADC
作为ADC的靶点,CDH3 在实体瘤细胞表面高度表达且具有明显的肿瘤选择性,同时具备良好的内吞能力,这使得抗体可以高效定位并递送细胞毒载药,最大化肿瘤杀伤效应同时降低正常组织毒性。基于这一优势,全球多个生物制药团队已将CDH3作为核心靶点开展创新药研发。
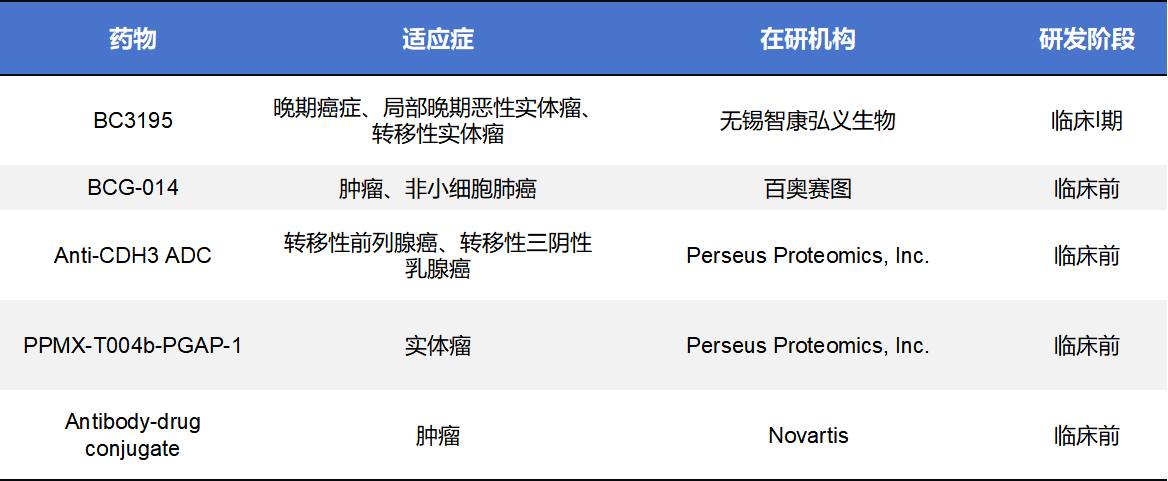
BC3195 是一款由BioCity Biopharma开发的全球首个靶向 CDH3(P-cadherin)的ADC药物。该药物由高亲和力抗CDH3单抗与微管抑制剂MMAE通过可裂解连接子偶联而成,通过结合肿瘤细胞表面的CDH3并介导内吞,实现载药在肿瘤细胞内的定向释放,从而诱导细胞周期阻滞与凋亡。BC3195目前处于I期临床试验阶段,在中美同步开展剂量爬坡及扩展研究。已披露的早期结果显示,其在晚期实体瘤,尤其是非小细胞肺癌患者中表现出可观的初步疗效和可控的安全性,验证了CDH3作为ADC靶点的临床可行性,并为后续联合治疗策略奠定了基础。
BCG-014是由百奥赛图(Biocytogen Pharmaceuticals)开发的新型靶向CDH3(P-cadherin)ADC候选药物,其载体抗体识别CDH3并伴随优异的细胞内内吞特性。与传统ADC不同,BCG-014采用了一种新型拓扑异构酶I(TOP1)抑制剂作为药物载荷,使其在进入肿瘤细胞后不仅能阻断微管,还能通过干扰DNA拓扑异构酶I活性引发细胞死亡,提升细胞杀伤路径的多样性。该候选物目前处于临床前研发阶段,在多个患者来源异种移植(PDX)模型中显示了广泛的抗肿瘤活性和良好的体内敲减效应,正在进一步评估其药效、药代和安全性特征,为推进临床试验奠定基础。
此外,布局CDH3 ADC的还有日本药企Perseus Proteomics和Novartis,不过目前均处于临床前阶段。
4.2 CDH3双特异性抗体与其他
除了ADC之外,在CDH3靶向药物开发中,抗体和双特异性抗体(BsAb)也是重要的方向。一类是针对CDH3的单克隆抗体,如由Perseus Proteomics研发的PPMX-T002,这是一种针对CDH3的调节性抗体,目前处于临床前阶段,用于探索其作为基础生物药物的抗肿瘤潜力,包括对胆道癌和卵巢癌等实体瘤模型的作用评估。此外,科研和企业界还在开发多种CDH3xCD3双特异性抗体,例如Creative Biolabs的CDH3xCD3 DART项目,基于双特异性DART 架构将T细胞与CDH3表达肿瘤细胞连接,旨在激活T细胞介导的杀伤作用,已在早期免疫肿瘤学探索中展示了机制合理性。还有研究报道的TRAILR2/CDH3双抗概念,通过同时结合 CDH3和TRAILR2促进肿瘤细胞凋亡,在胰腺癌等多种实体瘤模型中显示出选择性抗肿瘤活性,这类跨受体的双抗策略为CDH3靶向治疗提供了新的功能性方向。与此同时,除了抗体类生物药,学术界也在探索 CDH3 表达与小分子药物敏感性的关联,提示以 EGFR 抑制剂等 间接策略 结合标准治疗可能增强受益,但目前尚无直接作用的小分子CDH3靶点抑制剂进入临床试验阶段。 相比ADC平台,这些非ADC模态处于更早期的研发阶段,但为未来组合疗法及免疫调节策略提供了更广阔的可能性。
五、缔码生物CDH3全系列产品助力靶向治疗
围绕 CDH3(P-cadherin)靶点,缔码生物已建立一系列产品体系,满足靶向治疗研发过程中的关键检测需求。目前产品涵盖CDH3重组蛋白,可用于抗体筛选及结合活性评估;经流式验证的CDH3单克隆抗体,适用于细胞表面表达检测与亲和力分析;以及稳定表达CDH3的细胞株,为流式检测与功能筛选提供可靠模型支持。该系列产品可作为CDH3靶向治疗项目早期筛选与验证的标准化工具组合。
- CDH3系列产品
|
SKU |
Product_type |
Product name |
|
PME100802 |
ECD Proteins |
|
|
PME101596 |
||
|
PME-M100118 |
||
|
PME-C100077 |
||
|
PME101613 |
||
|
PME101614 |
||
|
PME101615 |
||
|
PME101616 |
||
|
DMC101041 |
Monoclonal antibodies |
|
|
DMC101041B |
||
|
DMC101041P |
||
|
CEL100060 |
Overexpression Stable Cell Line |
- CDH3先导分子进度

参考文献
- Paredes J, Correia AL, Ribeiro AS, Albergaria A, Milanezi F, Schmitt FC. P-cadherin expression in breast cancer: a review. Breast Cancer Res. 2007;9(5):214.
- Vieira AF, Paredes J. P-cadherin and the journey to cancer metastasis. Mol Cancer. 2015 Oct 6;14:178.
- Albergaria A, et al. P-cadherin role in normal breast development and cancer. International Journal of Developmental Biology, 2011.
- Ribeiro AS, et al. P-cadherin signals through the laminin receptor α6β4 integrin to induce stem cell and invasive properties. Molecular Oncology, 2014.


