近年来,趋化因子受体在免疫调节、肿瘤发展及组织修复中的作用日益受到关注。C-X-C趋化因子受体7(C-X-C chemokine receptor type 7,CXCR7),也称为ACKR3(Atypical Chemokine Receptor 3),作为CXCL12/CXCL11的非典型受体,因其独特的信号机制和在多种疾病中的功能角色,成为了靶向药物研发的重要新星。
1. CXCR7结构及表达
1.1 结构
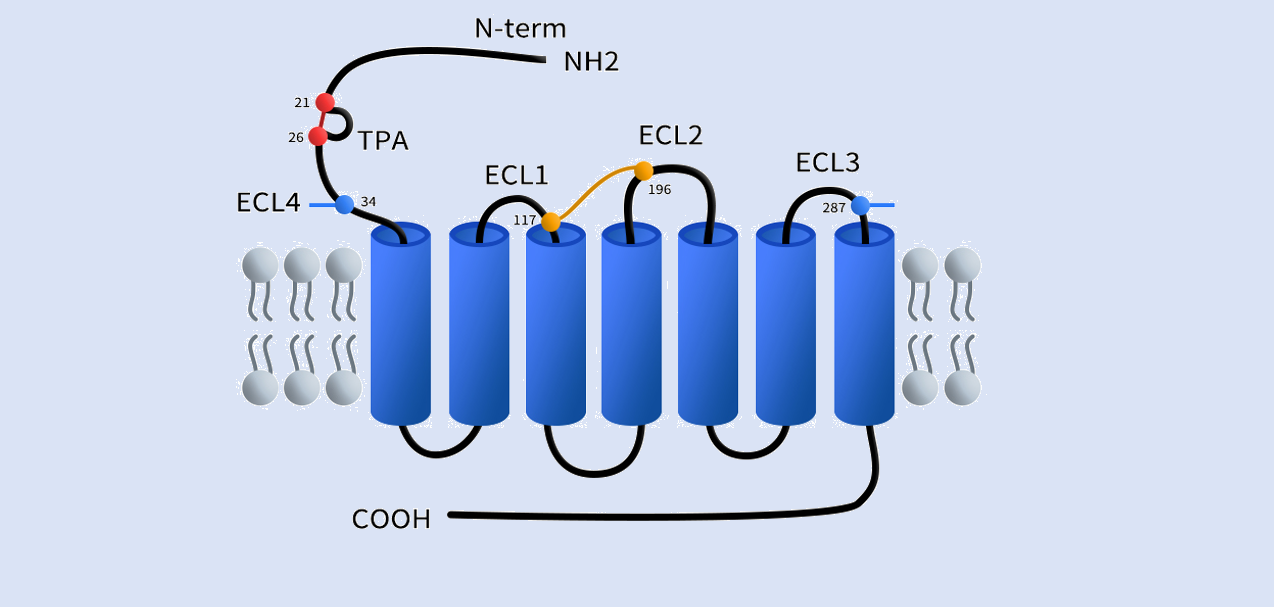
CXCR7属于非典型GPCR家族(ACKR),其在结构上展现出一些与典型GPCRs截然不同的特征,尤其是在其胞外结构区域。首先,CXCR7的N末端结构独特,21位和26位半胱氨酸(Cys)可形成一个特有的二硫键,从而构建一个稳定的N-terminal loop,这一内环结构被认为与配体识别和受体稳定性密切相关。此外,CXCR7还在第七跨膜区(TM7)和其上方的胞外环(通常被称为ECL4)之间存在另一个重要的二硫键,这一结构在大多数GPCR中并不常见,可赋予CXCR7独特的构象稳定性和构象特异性,有助于其对CXCL12和CXCL11等趋化因子进行高亲和力结合。这些二硫键的存在不仅增强了CXCR7在胞外区域的结构稳定性,也在其调节趋化因子活性、调控细胞迁移和调节GPCR信号转导中的非典型功能中发挥关键作用。[1]
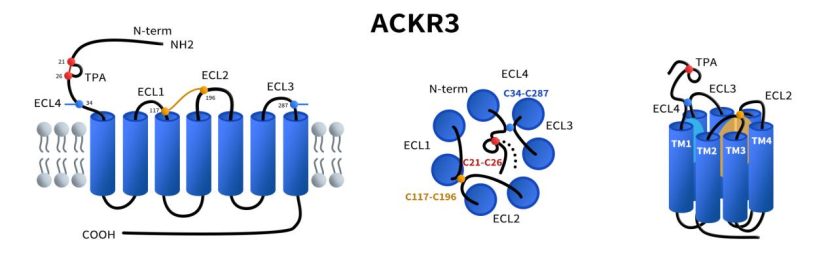
Fig 1. The struture of chemokine receptor CXCR7(ACKR3).[1]
1.2 表达
CXCR7在人体B细胞、树突状细胞及肿瘤相关内皮细胞中表达,并参与CXCR4的信号调控与配体清除功能。[2]
1.2.1 正常生理状态
CXCR7在外周血中祖细胞及淋巴细胞中的表面表达极低,但在次级淋巴器官(如脾脏边缘区 B 细胞、树突细胞等)可检测到其表达。此外,CXCR7在心脏、神经组织、血管内皮细胞及胚胎发育期中也呈高表达,如在成年小鼠中,脾脏红髓、边缘区B细胞以及海马、嗅球神经细胞和 CD31+ 血管细胞均有显著分布。[2]
1.2.2病理状态
- 肿瘤
CXCR7在多种实体瘤(包括乳腺癌、肺癌、肾癌、前列腺癌、胶质母细胞瘤等)中显著上调,常与侵袭力增强、血管生成和不良预后相关。[3] 研究发现超过30%的乳腺癌样本中 CXCR7高表达,并且肿瘤血管中表达更高,与整体及无肺转移生存期显著相关。[4] 在胶质母细胞瘤患者中,CXCR7高表达患者预后显著较差(HR ~2.8),与常规治疗末期存活率降低有关,同时肿瘤及其血管组织均可检测到CXCR7阳性表达,而正常脑组织中几乎不表达 CXCR7。
- 炎症与心血管疾病
急性冠状动脉综合征患者其血小板表面CXCR7表达上调,与较低的ADP和TRAP诱导聚集反应相关,提示其可能具有抗血栓功能。药理激动ACKR3(如小分子VUF11207)可诱导platelet内吞并下调聚集反应,相比CXCL12有差异性信号调节作用。[5]
- 自身免疫与炎症病理
CXCR7在类风湿性关节炎、炎症性肠病、实验性过敏性脑炎(EAE)等免疫病模型中其表达显著增加。其表达可被细胞因子如 IL‑1β、CXCL8、LPS等诱导上调,参与炎症微环境和免疫细胞迁移调节。[2]
2. CXCR7介导的信号
CXCR7主要通过β‑arrestin招募启动细胞内信号,如ERK和Akt通路,促进细胞生存与迁移。由于CXCR7具有多种配体,它能够通过多种作用方式触发下游效应,尤其是在 CXCL12/CXCR4/CXCR7相关信号传导方面。CXCR7最早被发现的功能之一是其“清道夫”活性,以调节表达 CXCR4 的细胞的迁移能力:当与趋化因子结合后,CXCR7会发生内化,并将配体降解于溶酶体中。[6] 因此,CXCR7能够调控胞外CXCL12的浓度,进而调节 CXCL12/CXCR4介导的信号传导。在CXCL12/CXCR4/CXCR7轴中,CXCR7常通过异源二聚体方式修饰CXCR4信号,增强或干扰CXCR4的趋化功能。此外,在乳腺癌等模型中,该轴调控ERK‑PKM2‑β-arrestin 信号网络,诱导肿瘤细胞糖代谢重编程,促进增殖与侵袭,CXCR7相较于CXCR4更主导此代谢效应。
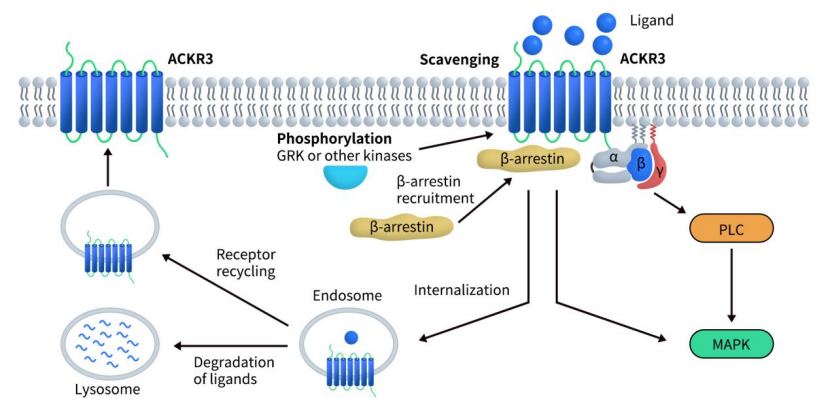
Fig 2. Schematic representation of signaling pathways for CXCR7(ACKR3).[6]
3. CXCR7相关疾病及药物开发现状
3.1 CXCR7相关疾病
- 肿瘤
CXCR7在多种实体瘤中高表达,包括乳腺癌、肝癌、肺癌、前列腺癌、胶质瘤等。其高表达常与肿瘤侵袭性增强、转移能力提升及预后不良相关。研究发现,CXCR7促进肿瘤细胞的增殖、抗凋亡以及新生血管形成,同时通过调节免疫微环境促进肿瘤免疫逃逸。[3]
- 心血管疾病
在心肌梗死、缺血再灌注等模型中,CXCR7对心肌细胞具有保护作用,可抑制细胞凋亡、促进组织修复。其在心脏发育中也发挥关键调控功能,特别是在内皮-心肌相互作用方面。[2, 3]
- 中枢神经系统疾病
CXCR7在多发性硬化、阿尔茨海默病及中风恢复中呈现上调趋势,可能通过影响神经元存活、胶质细胞激活及血脑屏障通透性发挥作用。[2]
- 炎症与自身免疫疾病
CXCR7调控免疫细胞的迁移与炎症因子的表达,在类风湿性关节炎、炎症性肠病、银屑病等疾病中被认为是潜在的治疗靶点。[2]
3.2 药物开发现状
CXCR7作为新兴靶点,目前已进入多个适应症的药物研发阶段。主要药物类型包括小分子拮抗剂、单克隆抗体及相关信号干扰分子。
- 小分子拮抗剂
CCX771 由 ChemoCentryx 开发,曾在实验性过敏性脑炎(EAE)小鼠模型中显著缓解多发性硬化症状,同时抑制胶质瘤增殖并提高生存率;还可降低高脂模型中VLDL水平,减轻动脉粥样化。不过,该分子在某些环境下也表现出β‑arrestin 招募能力,其拮抗/激动特性存在争议。
ACT-1004-1239是一种口服活性CXCR7拮抗剂,经结构优化具备优良药代动力学性能,并能拮抗 CXCL11/12 诱导的β‑arrestin招募;给药模型中明显提升循环CXCL12水平,正在朝临床评价推进。
- 单克隆抗体类
X7Ab为功能性中和抗体,可通过阻断CXCR7与配体结合来抑制肿瘤生长与转移,目前在动物模型中具有显著抗肿瘤活性(未在公开文献详细披露结构或临床数据)。
- 联合干预策略
考虑CXCR4与CXCR7的协同作用,联合拮抗CXCR4(如 AMD3100)和CXCR7的药物可能在肿瘤治疗、干细胞动员方面展现更优疗效,是未来研究热点之一。
CXCR7的开发仍处于临床前及早期临床阶段,目前缺乏上市药物。此外,CXCR7异于常规GPCR信号机制,其表达特异性与复杂的β-arrestin信号网络,使得药物评估与模式开发具挑战性。
4. CXCR7靶点相关产品
由于CXCR7属于GPCR家族,其结构具有高度动态性,胞内环区域较短,传统的表达和纯化方式往往难以满足功能研究及药物筛选的需求。为解决这一难题,我们基于 Synthetic Nanodisc技术,采用哺乳动物细胞表达系统,成功构建了类生理状态下稳定呈现构象的 CXCR7-Nanodisc全长膜蛋白产品。该产品高度保留膜蛋白的天然结构特征,显著提升了抗体结合分析、功能验证和小分子/配体筛选的可行性与准确性。
- 数据展示
Human CXCR7 full length protein-synthetic nanodisc (Cat.No.FLP100095)
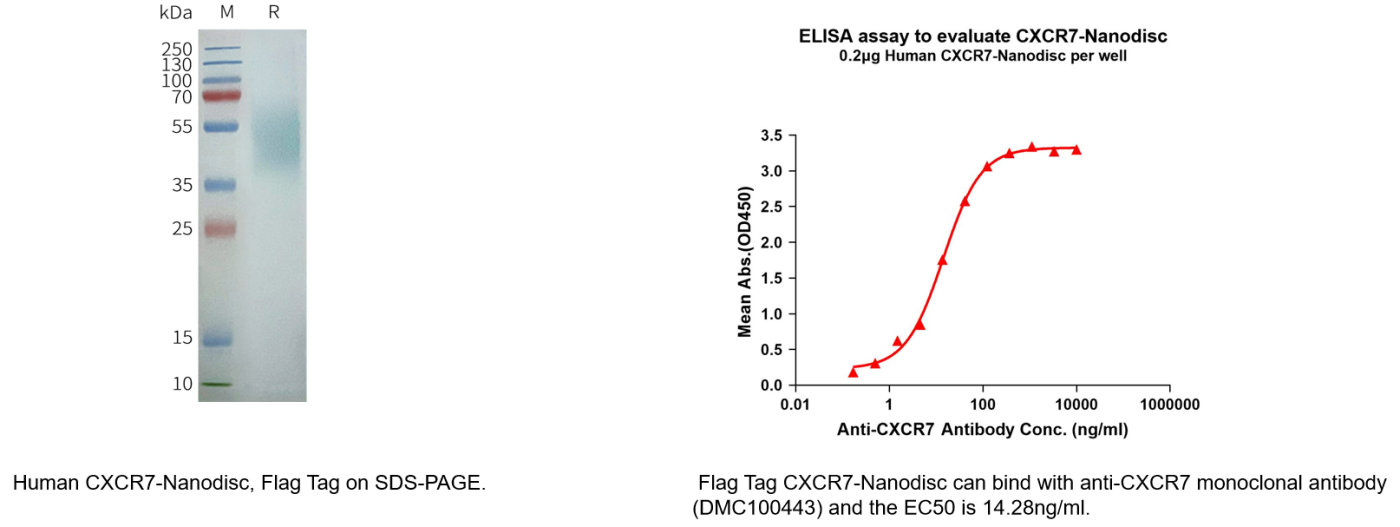
Biotinylated Human CXCR7 full length protein-synthetic nanodisc(Cat.No.FLP100095B)
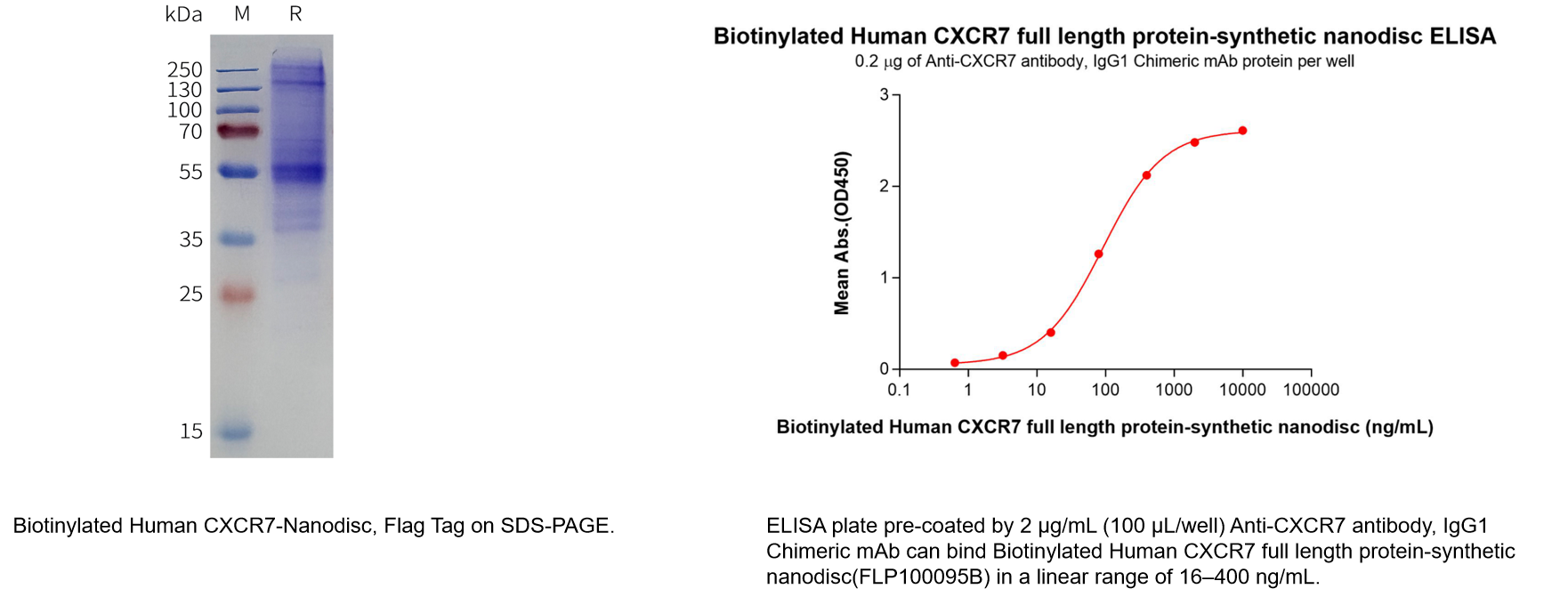
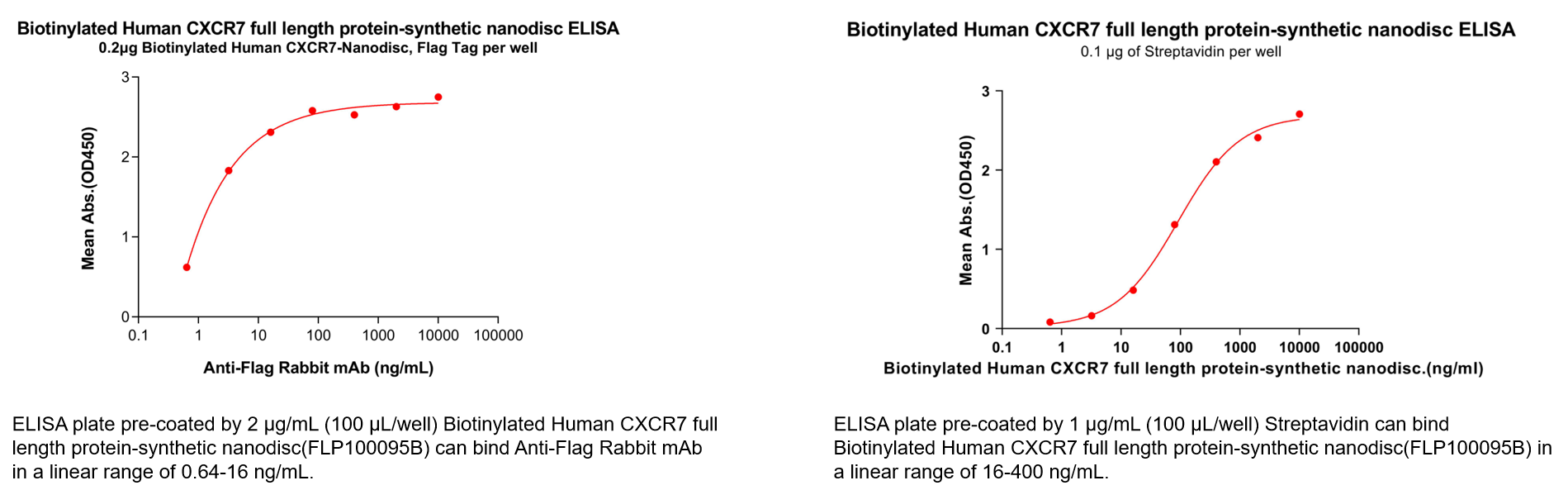
此外,我们还提供重组蛋白,以及多种形式的重组单克隆抗体(包括未标记、Biotin标记及PE标记),以满足不同科研及药物开发阶段的实验需求。我们还可以提供系统的服务,包括蛋白/抗体定制服务、抗体人源化、抗体亲和力成熟、稳转细胞株等。此外,我们已经建立了CXCR7靶点的B细胞种子库,可快速在20天内筛选出客户所需的先导抗体分子。如需了解更多详情,欢迎垂询。(400-006-0995 / 18062749453)
- CXCR7相关产品目录
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100228 | Human CXCR7 Protein, hFc Tag |
| 全长膜蛋白 | FLP120095 | Human CXCR7-Strep full length protein-synthetic nanodisc |
| FLP100095 | Human CXCR7 full length protein-synthetic nanodisc | |
| FLP100095B | Biotinylated Human CXCR7 full length protein-synthetic nanodisc | |
| 重组单克隆抗体 | DMC100443 | Anti-CXCR7 antibody(DMC443); IgG1 Chimeric mAb |
| DMC100443B | Biotinylated Anti-CXCR7 antibody(DMC443); IgG1 Chimeric mAb | |
| DMC100443P | PE-conjugated Anti-CXCR7 antibody(DMC443); IgG1 Chimeric mAb |
- CXCR7靶点先导分子进度
参考文献
1. Szpakowska, M., et al., Mutational analysis of the extracellular disulphide bridges of the atypical chemokine receptor ACKR3/CXCR7 uncovers multiple binding and activation modes for its chemokine and endogenous non-chemokine agonists. Biochem Pharmacol, 2018. 153: p. 299-309.
2. Garcia-Cuesta, E.M., et al., The Role of the CXCL12/CXCR4/ACKR3 Axis in Autoimmune Diseases. Front Endocrinol (Lausanne), 2019. 10: p. 585.
3. Wang, C., W. Chen, and J. Shen, CXCR7 Targeting and Its Major Disease Relevance. Front Pharmacol, 2018. 9: p. 641.
4. Behnam Azad, B., et al., Targeted Imaging of the Atypical Chemokine Receptor 3 (ACKR3/CXCR7) in Human Cancer Xenografts. J Nucl Med, 2016. 57(6): p. 981-8.
5. Cebo, M., et al., Platelet ACKR3/CXCR7 favors antiplatelet lipids over an atherothrombotic lipidome and regulates thromboinflammation. Blood, 2022. 139(11): p. 1722-1742.
6. Duval, V., et al., Emerging Roles of the Atypical Chemokine Receptor 3 (ACKR3) in Cardiovascular Diseases. Front Endocrinol (Lausanne), 2022. 13: p. 906586.