膜蛋白是维持细胞生理过程最重要的组成部分,在物质运输、信号转导和细胞间识别等多种细胞功能中发挥着重要作用,人类基因组中编码的膜蛋白约占总蛋白质组的25%。目前膜蛋白药物靶点占现阶段己知药物靶点的60%以上,而抗体药靶点中膜蛋白占90%以上,例如 BCMA、GPRC5D、CCR8 [1]。 尽管膜蛋白发挥着至关重要的作用,但他们的制备是极具挑战性的,尤其是多次跨膜蛋白。多跨膜蛋白具有两个或两个以上跨膜区,可以依靠自身的复杂结构进行形变,并通过结构的改变来完成信号转导。 由于存在跨膜区的疏水结构域,在体外容易聚合,使得其在体外难以保持其正确的天然空间构象,从而影响蛋白的正常功能。因此如何让膜蛋白在体外仍保持其天然构象,是膜蛋白表达纯化过程中面临的重要问题。另外如何提高蛋白纯度,也是需要解决的问题之一。缔码独创的DiMPro™合成纳米圆盘(Synthetic Nanodisc)为为这些多穿膜蛋白提供了一个可行的解决方案。
1、什么是Nanodisc?
Nanodisc中文名称为纳米磷脂盘或纳米圆盘,其概念最早由伊利诺伊大学的Stephen G. Sligar教授于2002年提出。
20世纪90年代末,Sligar教授在为原子力显微镜(AFM)结构研究寻找优秀候选者时,因受到同校Ana Jonas教授研究的启发而提出了Nanodiscs可作为研究膜蛋白结构和功能有力工具。Ana Jonas教授的研究重点是动脉粥样硬化过程中高密度脂蛋白 (HDL) 的主要循环形式。她发现这些形式通常以不同大小的球体形式存在,含有胆固醇酯、脂质和蛋白质。此外,她还发现了一种短暂形式的HDL,其形状大致呈盘状,并由两亲性载脂蛋白 A-I (Apo-AI) 稳定。
受到 Jonas 教授工作的启发,Sligar教授团队通过从富含脂质的 Apo-AI 组分(从人体血液中分离获得)中去除去污剂,重建了更大的HDL颗粒,并将这些HDL颗粒在原子扁平云母上成像 [2] [3]。 他们发现这些颗粒极其异质,尺寸分布的峰值对应于重复Apo-AI 蛋白的长度,这表明这些颗粒通常存在一个特定的尺寸范围 [4]。为了制造尺寸均匀的纳米颗粒,Sligar教授合成了可在大肠杆菌中表达的重组Apo-AI 编码序列,并修改了重塑程序。 通过这种基因工程和重塑过程,研究人员成功生产了一组称为“膜支架蛋白”(MSP)的蛋白质,它们可以自组装成称为Nanodiscs的盘状磷脂双层。这些纳米圆盘被磷脂烷基链周围的两亲性螺旋带包裹,可以模拟膜蛋白的自然环境,并为其分析提供稳定的平台 [5]。自推出以来,纳米圆盘彻底改变了膜蛋白研究领域,并成为药物发现和递送的宝贵工具。 它们的小尺寸、稳定性和模仿细胞膜的能力使它们成为提供治疗的理想载体。
2、Nanodisc的优势有哪些?
除了Nanodisc之外,制备功能性多次跨膜蛋白还有很多解决方案,包括去垢剂、胞外结构域(ECD)、膜组分、全细胞和VLP 等[6]。其中,去垢剂应用最广。但是,使用去垢剂最大缺点是蛋白质需要保留在含有去垢剂的溶液中,并且去垢剂不能完全去除。这会对蛋白质结合和下游实验产生影响。
选择表达蛋白的胞外结构域(ECD)虽然可以获得可溶性、正确折叠的蛋白质,但是,获得的产物与多次跨膜蛋白的天然结构和构象是不一样的。膜组分、全细胞和VLP方案虽然能维持多次跨膜蛋白的天然结构,但组分比较复杂,用其得到的蛋白进行免疫会产生高水平的非特异性抗体。与这些方案相比,Nanodisc利用具有疏水和亲水双重特性的物质作为稳定剂,稳定剂朝向内部脂层的疏水面可将膜蛋白整合到Nanodisc中,维持膜蛋白的天然空间构象和活性。同时,朝外的亲水面使得Nanodisc在水溶液中具有很高的溶解度和稳定性。通过nanodisc获得的蛋白不含去垢剂,适用于细胞实验。
3、Nanodisc类型有哪些?
根据稳定剂的不同,可将Nanodisc分为不同类型: MSP nanodisc和 Synthetic nanodisc.
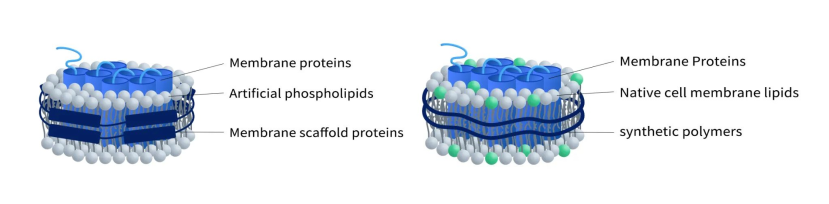
Figure 1. The structure of MSP-Nanodisc (left) and Synthetic Nanodisc (right)
3.1 MSP nanodisc
MSP nanodisc使用Membrane scaffold proteins(MSPs)作为稳定剂,包裹人工磷脂成分和跨膜蛋白,形成一个纳米圆盘。所形成的纳米圆盘的大小由所选用的MSPs决定,一般直径范围为7至13nm。 Nanodisc组装中常用的MSP,包括MSP1D1、MSP1D1-DH5和MSP1E3D1。 这些 MSP 已被广泛研究并证明可有效生成稳定且功能性的 Nanodisc 蛋白。其制备过程通常有两种形式:
- 组装溶解在去垢剂中的膜蛋白
在去垢剂存在的条件下将膜蛋白纯化,然后添加MSPs和磷脂。膜蛋白、MSPs和磷脂能够自发地组装成为nanodisc,去除掉去垢剂后可以通过尺寸排阻色谱或亲和纯化等方式来纯化。下图以A2AR蛋白为例,阐述具体过程。
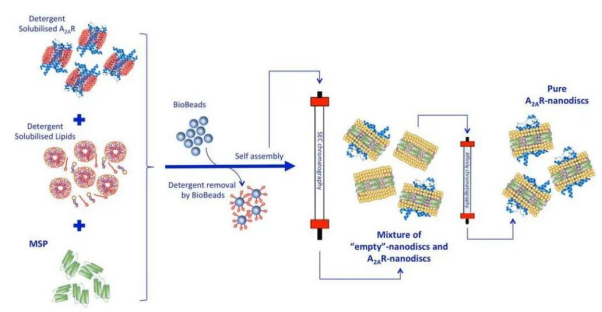
Figure 2. Assembly of MSP-Nanodisc [7]
- Nanodisc与无细胞表达体系相结合
将组装好的纳米圆盘加入到无细胞反应体系中。从表达质粒开始,膜蛋白可以在无细胞系统中产生并自发整合到纳米圆盘中。
3.2 Synthetic Nanodisc
与 MSP Nanodisc不同,Synthetic Nanodisc(合成纳米盘)是用合成聚合物生产的,通常包括苯乙烯-马来酸共聚物 (SMA) 和二异丁烯-马来酸 (DIBMA)。 每种聚合物都有其自身的优点和缺点。例如,DIBMA不吸收280 nm的光,这使其成为涉及使用光谱技术进行蛋白质分析的实验的理想选择。
合成纳米盘的组装起始于完整的细胞。它利用合成的聚合物溶解细胞膜,同时利用原生细胞磷脂在膜蛋白周围形成纳米盘结构。聚合物同时作为增溶剂和稳定剂。因此,不需要额外的去垢剂。
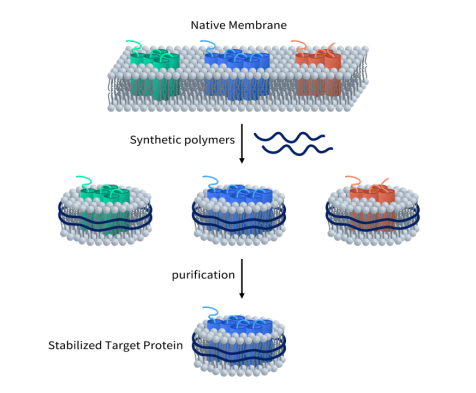
Figure 3. Assembly of Synthetic Nanodisc
4、如何选择合适的nanodisc?
MSP和Synthetic Nanodisc蛋白都实现膜蛋白的溶解和稳定。 但二者之间存在明显差异。
| MSP Nanodisc Protein | Synthetic Nanodisc Protein | |
| 稳定剂 | MSP | Polymer |
| 大小 | 7-17nm | Around 10nm |
| 磷脂组分 | Artificial phospholipid environments | Native cell membrane lipids |
| 磷脂来源 | Proteins obtained from Cell-free reaction or detergent-solubilized method | Directly from the cells |
| 是否需要去垢剂 | May use detergent during protein preparation | No detergent |
MSP Nanodisc蛋白质因其尺寸均匀而成为Cryo-EM等应用的完美工具。但因 MSP蛋白分子量大,它的存在会对目的蛋白产生干扰,而且在280nm处的吸光度无法轻松确定MSP Nanodisc蛋白质溶液中目标蛋白的量。此外,对于,由于去垢剂参与MSP Nanodisc蛋白制备过程中的细胞膜溶解,因此需要选择不干扰目标蛋白折叠的去垢剂。 但是,在Synthetic Nanodisc蛋白质中,聚合物既充当增溶剂又充当稳定剂,因此不需要洗涤剂。基于Synthetic Nanodisc蛋白的优势,缔码生物为全长多次跨膜蛋白开发了基于哺乳动物细胞表达系统的创新性合成纳米圆盘平台。
5、为何选择哺乳动物表达系统制备Nanodisc 蛋白?
缔码所有Nanodisc蛋白均由哺乳动物细胞表达系统制备,我们为何会选择哺乳动物表达系统呢?
首先,众所周知,哺乳动物细胞能够使蛋白质正确折叠并提供翻译后修饰,确保所得的Nanodisc蛋白质与其天然对应物非常相似。 这对于结构生物学和药物发现等应用非常重要,而且,蛋白质的天然结构对其功能至关重要。
其次,哺乳动物细胞为复杂和多次跨膜蛋白提供了有利的环境。这些类型的蛋白质通常需要特定的分子伴侣和辅助因子才能正确折叠和组装,与其他表达系统相比,这在哺乳动物细胞中更容易实现。这确保了所得的Nanodisc蛋白的功能和稳定性。
此外,哺乳动物细胞的使用允许掺入翻译后修饰,例如糖基化,这对于许多蛋白质的生物活性很重要。这些修饰可以影响 Nanodisc 蛋白质的结构和功能,使哺乳动物表达系统成为生产生物学相关蛋白质的首选。
总体而言,在 DIMA 生产 Nanodisc 蛋白时使用哺乳动物表达系统可确保蛋白在结构、功能和翻译后修饰方面与天然对应物非常相似,使其成为生物化学和生物医学领域广泛应用的理想工具。
Comparison of different expression hosts
| Expression Host | Pros | Cons | Recommend Usage |
| E.coli | EconomicFast | Inclusion bodies Not for large proteinNo PTMs | Bacterial proteinSmall proteins such as cytokine and enzyme |
| Yeast | FastLimited PTMs | No γ-carboxylationN-glycosylation focuses on Mannose. | Small proteins such as cytokine and enzyme |
| Baculovirus | FastLimited PTMs | No γ-carboxylationN-glycosylation is very simple without sialic acid. | secretory proteincytoplasmic proteintoxic protein. |
| Mammalian | diverse PTMsGood solubility | Low yield | Complex MPsRecombinant Antibody et al. |
6、缔码Synthetic Nanodisc
DiMPro™合成纳米圆盘是一种多次跨膜蛋白的创新性解决方案,具有以下优点:
- 高纯度全长膜蛋白
- 溶解度高
- 稳定性高,冻干粉常温下稳定
- 蛋白质处于天然膜环境中并保持生物活性
- 无需去垢剂,适用于细胞分析
- 无MSP骨架蛋白
该技术制备的多次跨膜蛋白可用于各种应用,包括 ELISA、SPR 亲和分析、噬菌体展示筛选、免疫、基于细胞的测定和蛋白质晶体结构分析等。
7、案例展示
Human MDR-1 full length protein-synthetic nanodisc (FLP100029) 12 transmembrane protein
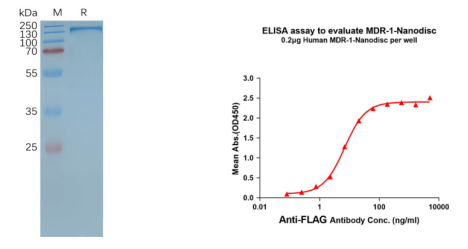
Figure 4. MDR-1-synthetic nanodisc validated data. (Left) Human MDR-1-Nanodisc, Flag Tag on SDS-PAGE; (Right) MDR-1-Nanodisc (FLP100029) can bind anti-Flag monoclonal antibody and the EC50 is 6.883ng/ml.
Human GPRC5D full length protein-synthetic nanodisc ( FLP100011) 7 transmembrane protein
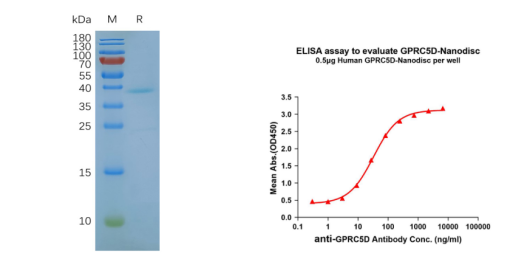
Figure 5. GPRC5D-synthetic nanodisc validated data. (Left) Human GPRC5D-Nanodisc, Flag Tag on SDS-PAGE; (Right) GPRC5D-Nanodisc (FLP100011) can bind anti-GPRC5D mAb (DME100090) and the EC50 is 32.86ng/ml.
Human CLDN6 full length protein-synthetic nanodisc (Cat. FLP100008) 4 transmembrane protein
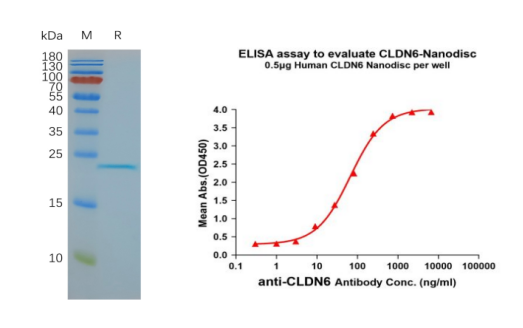
Figure 6. CLDN6-synthetic nanodisc validated data. (Left) Human CLDN6-Nanodisc, Flag Tag on SDS-PAGE; (Right) CLDN6-Nanodisc (FLP100008) can bind anti-CLDN6 mAb (BME100082) and the EC50 is 66.99ng/ml.
参考文献:
[1]Denisov, I., Sligar, S. Nanodiscs for structural and functional studies of membrane proteins. Nat Struct Mol Biol 23, 481–486 (2016).
[2] Jonas A, Kezdy KE, Wald JH. Defined apolipoprotein A-I conformations in reconstituted high density lipoprotein discs. J Biol Chem. 1989;264:4818–4824.
[3]Wald JH, Krul ES, Jonas A. Structure of apolipoprotein A-I in three homogeneous, reconstituted high density lipoprotein particles. J Biol Chem. 1990;265:20037–20043.
[4]Carlson JW, Jonas A, Sligar SG. Imaging and manipulation of high-density lipoproteins. Biophys J. 1997;73:1184–1189.
[5]Schuler MA, Denisov IG, Sligar SG. Nanodiscs as a new tool to examine lipid-protein interactions. Methods Mol Biol. 2013;974:415-33.
[6]Jo M, Jung ST. Engineering therapeutic antibodies targeting G-protein-coupled receptors. Exp Mol Med. 2016 Feb 5;48(2):e207.
Reis RI, Moraes I. Probing Membrane Protein Assembly into Nanodiscs by In Situ Dynamic Light Scattering: A2A Receptor as a Case Study. Biology (Basel). 2020 Nov 13;9(11):400.


