2022年3月,发表在《Nature Cancer》杂志上的一项研究表明,Cadherin 17 (CDH17)是胃肠道肿瘤(GIC,包括胃癌、胰腺癌、结直肠癌)和神经内分泌肿瘤(NET)嵌合抗原受体T细胞治疗的理想靶点。一时间,CDH17成了各大资讯平台报道的“明星”,同时也为进一步探索肿瘤相关抗原和开发治疗实体肿瘤的安全免疫疗法提供了新的思路。时隔2年,我们来看看目前针对CDH17靶点都有哪些免疫疗法的布局。在此之前,我们先来了解下CDH17的基本信息。
1、CDH17的结构
钙粘蛋白-17(CDH17),又称为肝肠钙粘蛋白(LI-cadherin)或人肽转运蛋白-1 (HPT-1),是钙粘蛋白(cadherin)超家族中结构独特的成员 [1]。cadherin是一类依赖于Ca2+的细胞粘附分子的超家族,属于I型膜蛋白。它们都是单次跨膜蛋白,N末端位于细胞外。cadherin的胞外部分通常由约110个氨基酸模块的多个重复组成,称为钙粘蛋白胞外域(EC),其中包含几个钙粘蛋白特异性基序。经典钙粘蛋白,例如 E-钙粘蛋白(CDH1)、N-钙粘蛋白(CDH2)和P-钙粘蛋白(CDH3),在胞外域内有5个EC结构域,胞内域由150-160个氨基酸组成,高度保守。
与经典钙粘蛋白不同,CDH17属于7D-cadherins,由一个包括七个胞外EC重复结构域、一个单次的跨膜域和一个短的胞质域组成。CDH17的EC1和EC2是源于EC5的两个重复结构域。经典钙粘蛋白EC1中第2位的保守色氨酸在CDH17中被苯丙氨酸取代。CDH17含有RGD 基序,位于EC6结构域中。该基序对于与α2β1整合素的相互作用以及癌症转移细胞中后整合素通路的激活至关重要。除了胞外EC重复结构域数量不同,CDH17和经典钙粘蛋白之间的另一个显着差异是CDH17的非常短(20 个氨基酸)的细胞质结构域,与经典钙粘蛋白的高度保守的细胞质区域(150个氨基酸)或任何其他钙粘蛋白亚家族的细胞质部分没有相似性。特别是无法识别犰狳蛋白(人类中称为β-连环蛋白,β-catenin)的结合位点,而犰狳蛋白是与连环蛋白相互作用以及与细胞骨架相互作用所必需的 [3] [4]。
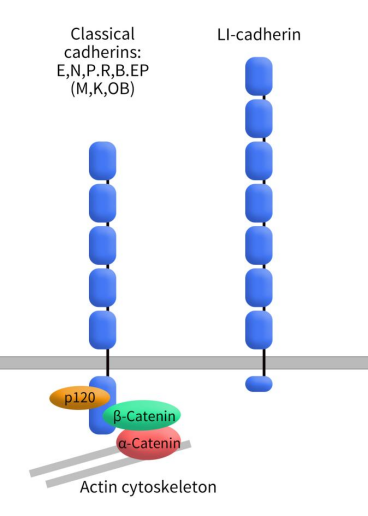
Figure 1. The structure of Classical cadherins and cadherin-17
经典钙粘连蛋白是通过与细胞质内的钙连环蛋白相互作用来调控细胞的粘附功能。尽管CDH17胞质区很短,但其在细胞粘附过程中同样发挥了非常重要的作用。有研究表明,CDH17的胞外部分可能独自担当调节细胞粘附功能的工具。CDH17在细胞粘附过程中并不通过与钙连环蛋白结合而发挥作用,有可能是直接与细胞支架连接而实现细胞之间的粘附。但具有的作用机制尚不明确,还需要进一步研究。
2、CDH17的分布
CDH17最初是在大鼠肝脏和肠道中发现的,所以也被称为肝肠钙粘蛋白。在人体中,CDH17的分布范围仅限于十二指肠、空肠、回肠、结肠以及部分胰腺导管,在健康的成人肝脏、肾脏和心脏等其他组织中很少检测到 [5]。在肠道上皮中,CDH17主要定位在细胞的侧面和基底侧膜上。在肿瘤细胞中,与Claudin18.2等特异性靶点相似,由于缺乏极性,CDH17在肿瘤细胞表面均表达。研究发现,CDH17在胃癌、结直肠癌、胆管癌、胰腺癌及肝细胞癌中均有不同程度的表达。而且,CDH17与多种实体瘤预后相关,在胃癌和结直肠癌患者中其高表达与更短的生存期和疾病无进展相关。
3、CDH17在肿瘤中的作用机制
尽管对于CDH17与肿瘤相关作用机制尚未有明确的解释,但目前对于相关作用机制已开展多项研究。
在肝细胞癌中,John Luk等人发现CDH17粘附分子表达上调,并且在小鼠中可以转化癌前肝脏祖细胞为肝癌。siRNA介导的CDH17敲低可抑制原发性和高度转移性HCC细胞系的体外和体内增殖。CDH17抑制的抗肿瘤机制涉及Wnt信号传导失活,因为生长抑制和细胞死亡伴随着β-catenin重新定位到细胞质,并伴随着细胞周期蛋白D1的减少和视网膜母细胞瘤的增加 [6]。后来Felix H Shek等人又通过实验确定SPINK1为肝细胞癌中CDH17/β-catenin信号轴的下游效应器 [7]。
在胃癌中,Karl-F. Becke等人发现存在CDH17异常剪接体,尤其是伴有外显子8或外显子9缺失的CDH17表达改变在胃癌中占主导地位 [8]。Jin Wang等人验证了CDH17的下调不仅抑制MKN-45胃癌细胞的增殖、粘附和侵袭能力,而且还诱导细胞周期停滞。同时,NFκB信号通路也失活,下游蛋白包括VEGF-C和MMP-9减少。此外,沉默CDH17可显着抑制体内肿瘤生长,并且在没有CDH17表达的小鼠中未检测到淋巴结转移 [9]。
在结肠癌中,CDH17被证明能与α2β1整合素相互作用,并且是α2β1整合素活性调控细胞粘附和增殖的关键决定因素,以及能促进结肠直肠癌细胞获得肝转移的能力。
4、CDH17靶向药临床研究进展
目前针对CDH17靶点的药物几乎都处于早期临床或者临床前研发阶段,但是药物类型十分全面,包括ADC药物、单抗、双抗、三特异抗体药物和CAR-T药物 。
4.1 抗体药物偶联物(ADC)
当前产业聚焦点为ADC类候选药,在所有在研药物中约占50%。目前所有进入临床阶段的 CDH17 药物几乎均为 ADC。这类药物通过抗体识别CDH17并将细胞毒性载荷精准递送至肿瘤细胞,提高疗效同时降低脱靶毒性。这里重点展示了2025年有重要进展的几款CDH17候选药。
- HS-20110|翰森制药|临床I期
HS-20110是翰森制药研发的CDH17 ADC,由人源化抗体与拓扑异构酶抑制剂载荷构成,用于晚期实体瘤尤其是结直肠癌。2025年10月,翰森将该药在大中华区以外的全球权益独家授权给罗氏,获得8000万美元首付款及潜在高达14.5亿美元的里程碑及销售分成。目前HS-20110已在中国与美国开展I期临床试验,用于评估其在结直肠癌及其他实体瘤安全性、耐受性及初步疗效,标志着 CDH17靶向疗法在全球范围的战略布局正式启动。该项目是目前全球最受关注的CDH17 ADC项目。
- 7MW4911|迈威生物|I/II期临床
7MW4911 是迈威生物(Mabwell)自主研发的CDH17 ADC,由高特异性CDH17单抗、可裂解连接子及专有DNA拓扑异构酶I抑制剂载荷MF-6组成,旨在克服多药耐药并靶向胃肠道肿瘤。区别于其他CDH17 ADC,该候选药重点强调旁观者效应和耐药克服能力。2025年8月,该药获得中国NMPA及美国FDA的IND批准,可开展针对晚期结直肠癌及其他消化道肿瘤的I/II期临床试验。截至2025年11月,7MW4911已完成首例患者给药,正在评估安全性、耐受性、药代及初步疗效。其临床前数据在《Cell Reports Medicine》等刊物发表,显示对多种肿瘤模型具有显著抗肿瘤活性。
- CM518D1|康诺亚|I/II期临床
CM518D1是康诺亚(Keymed Biosciences)自主研发的 CDH17 ADC,通过特异性抗体将细胞毒载荷精准递送至CDH17高表达的实体瘤细胞,旨在治疗结直肠癌等消化道肿瘤,而且临床前数据显示较好的安全窗。该药于2025年4月获NMPA IND批准,目前在中国开展多中心、开放标签的I/II期临床研究,主要是针对晚期实体瘤患者开展剂量爬坡和扩展研究,旨在评估其安全性、耐受性及初步疗效,是康诺亚抗肿瘤ADC管线的重要组成部分。CM518D1的临床启动也引发市场关注,推动公司股价走高,标志着其实体瘤治疗布局的实质性推进。
- HDM2017|华东医药|I期临床
HDM2017是华东医药(Huadong Medicine)旗下全资子公司中美华东研发的CDH17 ADC,由抗CDH17单抗与拓扑异构酶I抑制剂通过可裂解连接子偶联而成,针对结直肠癌、胃癌、胰腺癌等CDH17高表达的消化道实体瘤。2025年7-10月,HDM2017在NMPA批准开展I期临床试验,随后美国FDA也批准其在美开展I期临床。最新进展显示,该药于2025年11月在中国完成了首例受试者给药,正在进行安全性、耐受性及初步疗效评估。HDM2017的全球权益由华东医药自主掌握,尚无重大转让动态报道。
- MRG007|乐普生物|I/II期临床
MRG007 是乐普生物研发的CDH17 ADC,针对结直肠癌、胰腺癌等CDH17高表达的胃肠道实体瘤,临床前数据显示其在多种GI癌症模型中具有良好的抗肿瘤活性和治疗指数。2025年1月,乐普生物与ArriVent BioPharma 签署全球独家许可协议,授权ArriVent在大中华区以外区域开发、生产和商业化MRG007,乐普生物可获得约4700万美元首付款及最高约11.6 亿美元里程碑款和销售分成。2025年6月,该药获得NMPA IND批准并启动I期临床试验,目前正在进行中;随后于11月获得美国FDA IND批件,加速全球临床布局。
- YL217|宜联生物|I期临床
YL217是苏州宜联生物医药(MediLink Therapeutics)基于自主TMALIN® 技术平台开发的 CDH17 ADC,旨在治疗CDH17高表达的消化道肿瘤如胃癌、结直肠癌等。2025年2月,YL217 获得美国FDA批准IND,随后也获得中国CDE临床许可,开启全球I期临床试验。2025年7月,该药在中国完成了首例I期受试者给药,试验在评估安全性、耐受性及初步疗效,并在全球多个中心招募晚期实体瘤患者。当前尚无公开的权益转让动态。
- SOT109|SOTIO Biotech|临床前
SOT109是由欧洲创新生物医药公司SOTIO Biotech开发的CDH17 ADC,采用Synaffix GlycoConnect®/SYNtecan E™技术,将exatecan载荷与高亲和力抗体连接,针对结直肠癌等CDH17高表达的消化道肿瘤。它已展示出在多个异种移植模型中的强效抗肿瘤活性和良好耐受性,显示出优异的治疗指数。SOTIO曾与中国Biocytogen签署授权协议,引入其全人源抗体用于构建该ADC,加速药物开发进程。SOT109目前处于临床前/IND准备阶段,计划于2026 年提交IND并启动I期临床试验。
- BR-116|博锐生物|临床前
BR-116 是浙江博锐生物制药(BioRay Biopharmaceutical)开发的一款双载荷ADC,即在一个CDH17抗体分子上同时结合了两类载荷,CDH17拮抗剂和TopI抑制剂,用于治疗CDH17高表达的胃肠道肿瘤。该药采用博锐的ADC技术平台,通过稳定连接实现靶向递送细胞毒,旨在提高抗肿瘤效应并改善安全性。BR-116目前处于临床前研发阶段,计划在2025年提交IND申请进入临床。2025 年的临床前数据显示其在前瞻性抗肿瘤活性和安全性方面具备良好潜力,为未来临床开发打下基础。
- 其他CDH17 ADC项目
随着 HS-20110、7MW4911、CM518D1、HDM2017、YL217以及TORL-3-600等多款CDH17靶向 ADC 相继进入临床阶段,CDH17已成为消化道肿瘤领域进展最快的新兴ADC靶点之一。除上述处于临床或临床探索期的项目外,全球范围内仍有多家药企持续布局CDH17 ADC,并在临床前或临床阶段推进差异化设计与技术验证。
表1. CDH17-ADC药物
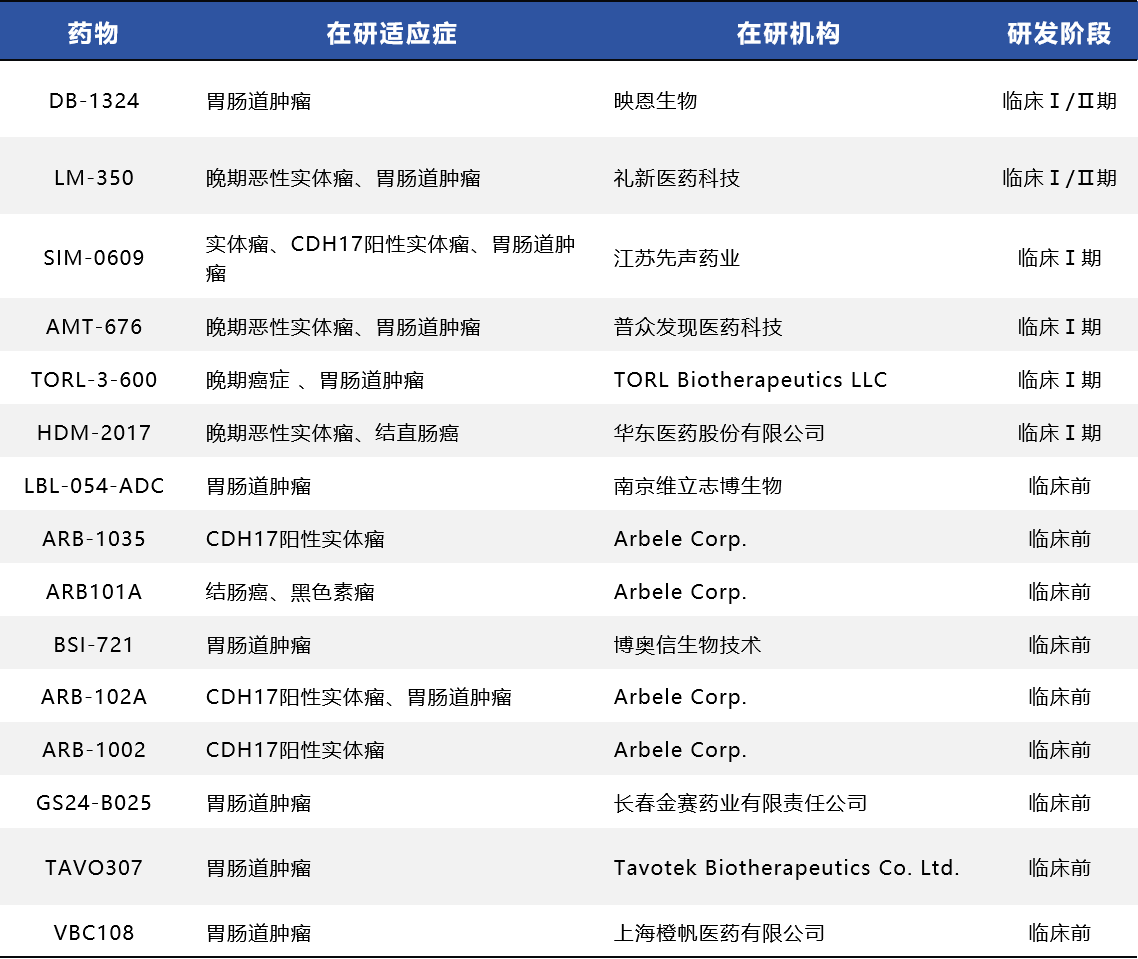
区别于其他CDH17 ADC药物,上海橙帆医药开发的VBC108是一款双特异性ADC,可同时靶向CDH17和CLDN18.2两个肿瘤相关抗原。该药作为潜在全球首创(FIC)双靶ADC在2025 年的AACR学术会议上公布了临床前数据,显示出良好的抗肿瘤活性和安全性,为推进临床试验奠定了基础,目前处于临床前研发阶段,预计2025-2026年进入美国与中国的临床开发阶段。其双靶设计旨在扩大适应症覆盖并降低脱靶风险。目前,CDH17 ADC已形成明显的中国企业主导+全球合作格局。
4.2 单克隆/双特异性/三特异性CDH17抗体
截至目前,进入临床阶段的CDH17抗体候选药仅两款,且均为双特异性抗体,其余大部分处于临床前(9),还有2款处于药物发现阶段。
- Cabotamig|Arbele Corp.|临床I期
Cabotamig(ARB202)是由Arbele开发的双特异性T细胞接合器,同时靶向肿瘤细胞的CDH17 和T细胞上的CD3,通过募集和激活T细胞来杀伤CDH17高表达的胃肠道肿瘤细胞。它属于“first-in-class” 双抗免疫治疗药物,正在开展 I 期临床试验用于晚期消化道癌患者的剂量探索与安全性评估,在第二次数据监测委员会审查后获推荐按计划继续剂量递增。研究覆盖胃肠道恶性肿瘤的多种病种,并对CDH17表达患者进行筛选。
- BI-905711|Boehringer Ingelheim|临床I期
BI-905711是Boehringer Ingelheim开发的一款四价双特异性抗体疗法,同时靶向TRAILR2和CDH17,通过促进TRAILR2 在CDH17高表达的肿瘤细胞中的聚集,从而特异性诱导肿瘤细胞凋亡并减少肝脏毒性风险。该药于2020年进入I期临床试验(NCT04137289),用于晚期胃肠道癌患者的安全性、耐受性、药代及初步疗效评估。初步数据表明在一些重度既往治疗患者中具有耐受性良好和疾病控制等早期信号,并继续在Ia/Ib剂量扩展阶段评估。
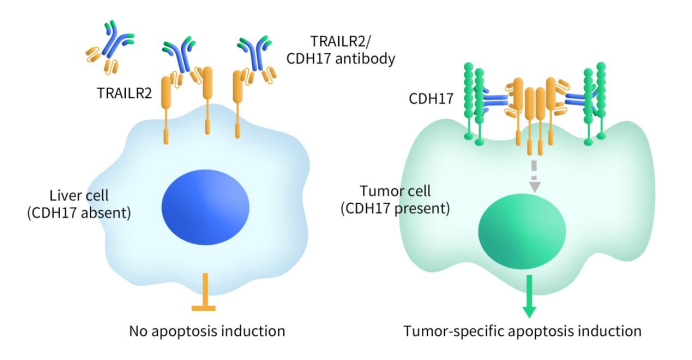
Figure 2. The mechanism of BI-905711
表2. CDH17-单克隆/双特异性/三特异性抗体药物
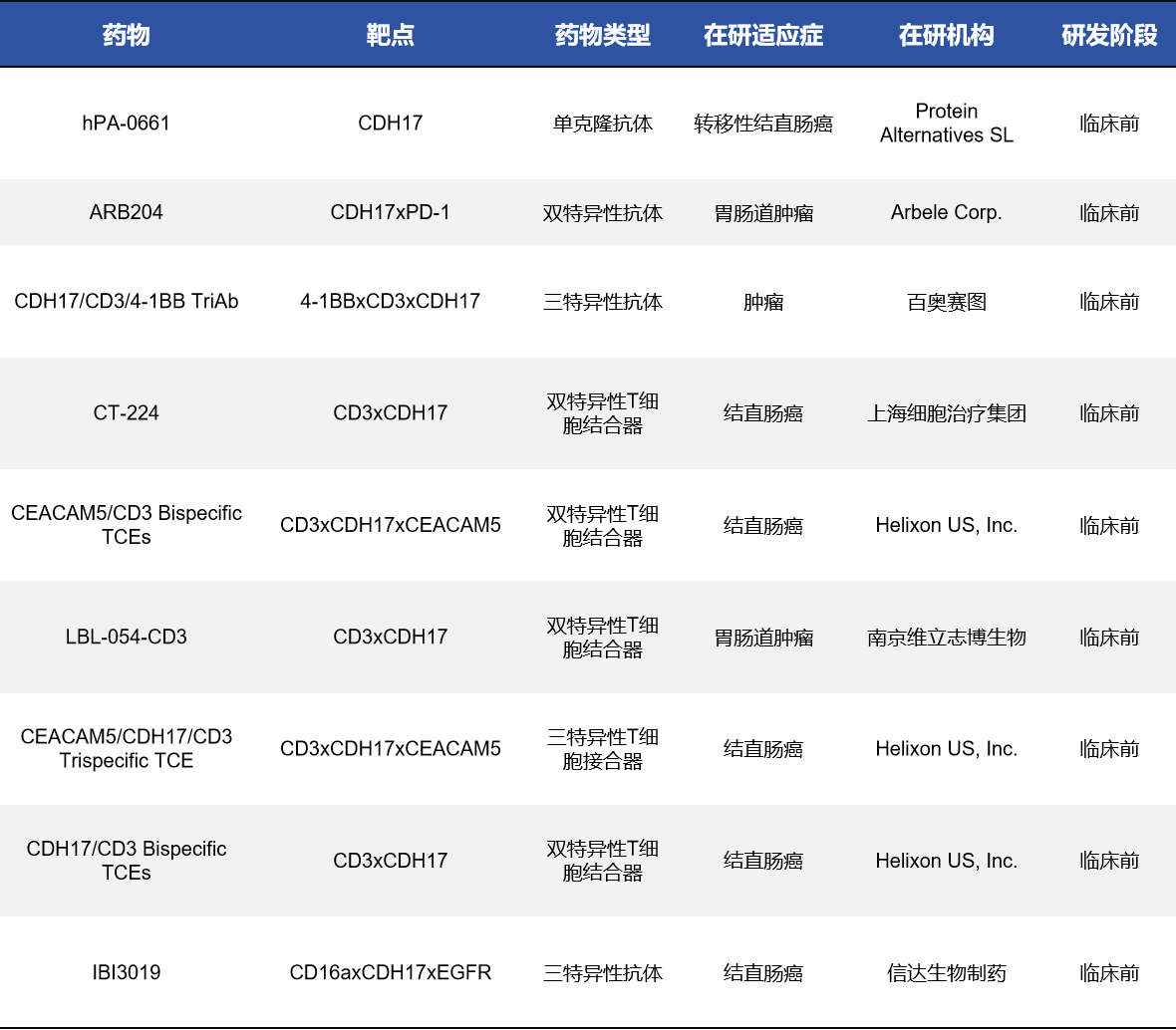
注:目前,CDH17单克隆抗体类药物并不多,主要是因为本身并非强信号转导受体,单抗阻断疗效有限,难以满足实体瘤治疗需求,目前更多作为ADC抗体骨架、多特异性抗体的靶点之一或CAR-T/ CAR-NK的识别结构来源。
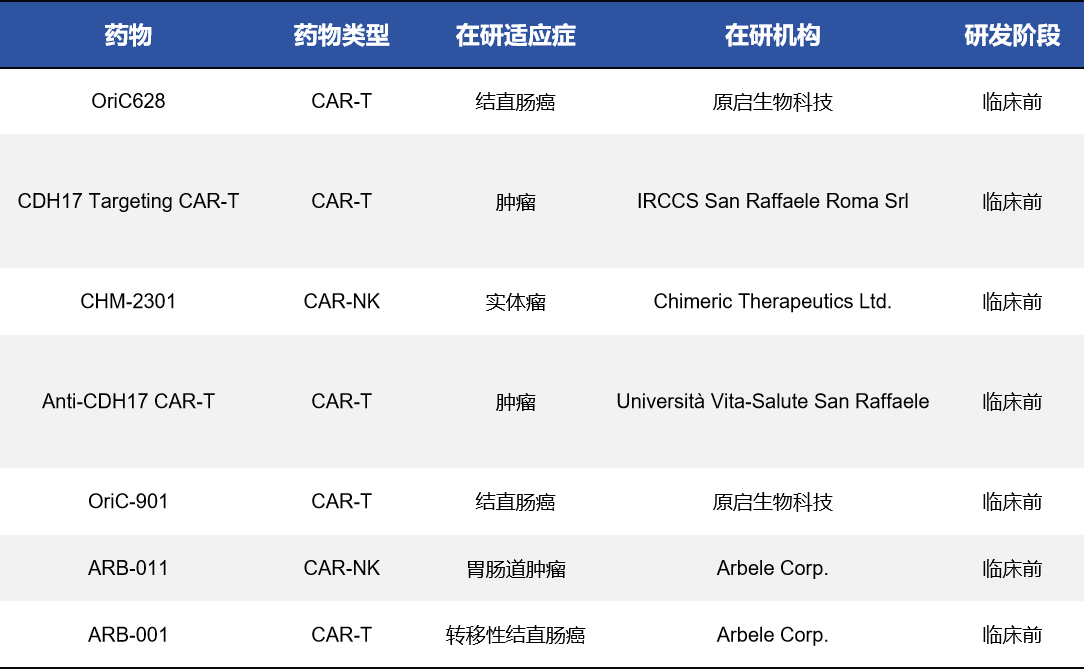
4.3 CDH17细胞疗法(CAR-T/ CAR-NK)
目前,CDH17 细胞疗法,如CDH17 CAR-T和CDH17 CAR-NK,均处于临床前探索阶段,研发主体包括原启生物科技、Arbele Corp、Chimeric Therapeutics等,适应症方向集中在结直肠癌和胃癌肝转移模型。这类疗法目前在动物模型中显示出明确肿瘤清除能力,可与PD-1抑制剂产生协同效应。不过,CDH17靶向细胞疗法在实体瘤中面临微环境免疫抑制和抗原异质性问题,同时在正常肠道上也存在潜在脱靶毒性,因此疗效和安全性需通过设计优化和剂量控制双重保障。
表3. CDH17-CAR-T药物
5、缔码生物CDH17相关产品助力CDH17生物药开发
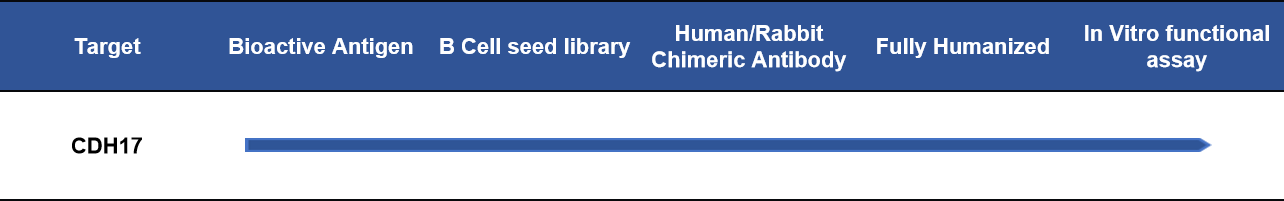
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供CDH17靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务涵盖多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速CDH17生物疗法的开发,缔码还制备了CDH17靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出有41个CDH17先导分子,其中有36个验证了人猴蛋白交叉反应,客户第二天可以拿到分子进行功能评估验证;针对部分分子,我们也正在进行ADC内吞活性及杀伤验证,具体数据欢迎垂询。
- CDH17蛋白&抗体
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100199 | Human CDH17(567-667) Protein, hFc Tag |
| PME101384 | Human CDH17(567-667) Protein, mFc Tag | |
| PME100801 | Human CDH17 Protein, His Tag | |
| PME-M100098 | Mouse CDH17 Protein, His Tag | |
| PME-C100029 | Cynomolgus CDH17 Protein, His Tag | |
| 流式验证抗体 | DMC100485 | Anti-CDH17 antibody(DMC485); IgG1 Chimeric mAb |
| 参照抗体 | BME100198 | Anti-CDH17(ARB102 biosimilar) mAb |
- CDH17先导分子研究进度
参考文献:
[1] Qiu HB, Zhang LY, Ren C, et al. Targeting CDH17 suppresses tumor progression in gastric cancer by downregulating Wnt/β-catenin signaling. PLoS One. 2013;8(3):e56959.
[2] Baumgartner W. Possible roles of LI-Cadherin in the formation and maintenance of the intestinal epithelial barrier. Tissue Barriers. 2013 Jan 1;1(1):e23815.
[3] Koch PJ, Goldschmidt MD, Walsh MJ, et al. Complete amino acid sequence of the epidermal desmoglein precursor polypeptide and identification of a second type of desmoglein gene. Eur J Cell Biol. 1991;55:200–8.
[4] Koch PJ, Walsh MJ, Schmelz M, et al. Identification of desmoglein, a constitutive desmosomal glycoprotein, as a member of the cadherin family of cell adhesion molecules. Eur J Cell Biol. 1990;53:1–12.
[5] Gessner R, Tauber R. Intestinal cell adhesion molecules. Liver-intestine cadherin. Ann N Y Acad Sci. 2000;915:136-43.
[6] Liu LX, Lee NP, Chan VW, et al. Targeting cadherin-17 inactivates Wnt signaling and inhibits tumor growth in liver carcinoma. Hepatology. 2009 Nov;50(5):1453-63.
[7] Shek FH, Luo R, Lam BYH, et al. Serine peptidase inhibitor Kazal type 1 (SPINK1) as novel downstream effector of the cadherin-17/β-catenin axis in hepatocellular carcinoma. Cell Oncol (Dordr). 2017 Oct;40(5):443-456.
[8] Karl-F. Becker, Michael J. Atkinson, Ulrike Reich, Hsuan-H. Huang, Hjalmar Nekarda, Jörg R. Siewert, Heinz Hofler, Exon skipping in the E-cadherin gene transcript in metastatic human gastric carcinomas, Human Molecular Genetics, Volume 2, Issue 6, June 1993, Pages 803–804.
[9] Wang J, Kang WM, Yu JC, Liu YQ, Meng QB, Cao ZJ. Cadherin-17 induces tumorigenesis and lymphatic metastasis in gastric cancer through activation of NFκB signaling pathway. Cancer Biol Ther. 2013 Mar;14(3):262-70.