急性髓样白血病(AML)是一种复杂且异质性极高的血液系统恶性肿瘤,其发生与多种细胞遗传学和染色体异常密切相关。其中,FMS样酪氨酸激酶3(FLT3)基因突变 是最常见的遗传改变之一。研究表明,约 25% 的AML患者携带 FLT3内部串联重复突变(FLT3-ITD),而约 10% 的患者具有 FLT3酪氨酸激酶结构域突变(FLT3-TKD)。这些突变通常导致FLT3信号通路的持续激活,促进白血病细胞异常增殖,并与较差的预后相关。
尽管FLT3突变型AML患者在传统化疗或造血干细胞移植(HSCT)后可能获得短暂缓解,但他们的复发风险更高,治疗挑战也更大。因此,FLT3已成为AML研究和治疗的关键靶点,针对该受体的靶向治疗策略正在不断发展和优化。接下来,我们将深入探讨FLT3受体及其临床药物进展。
1. FLT3结构与分布
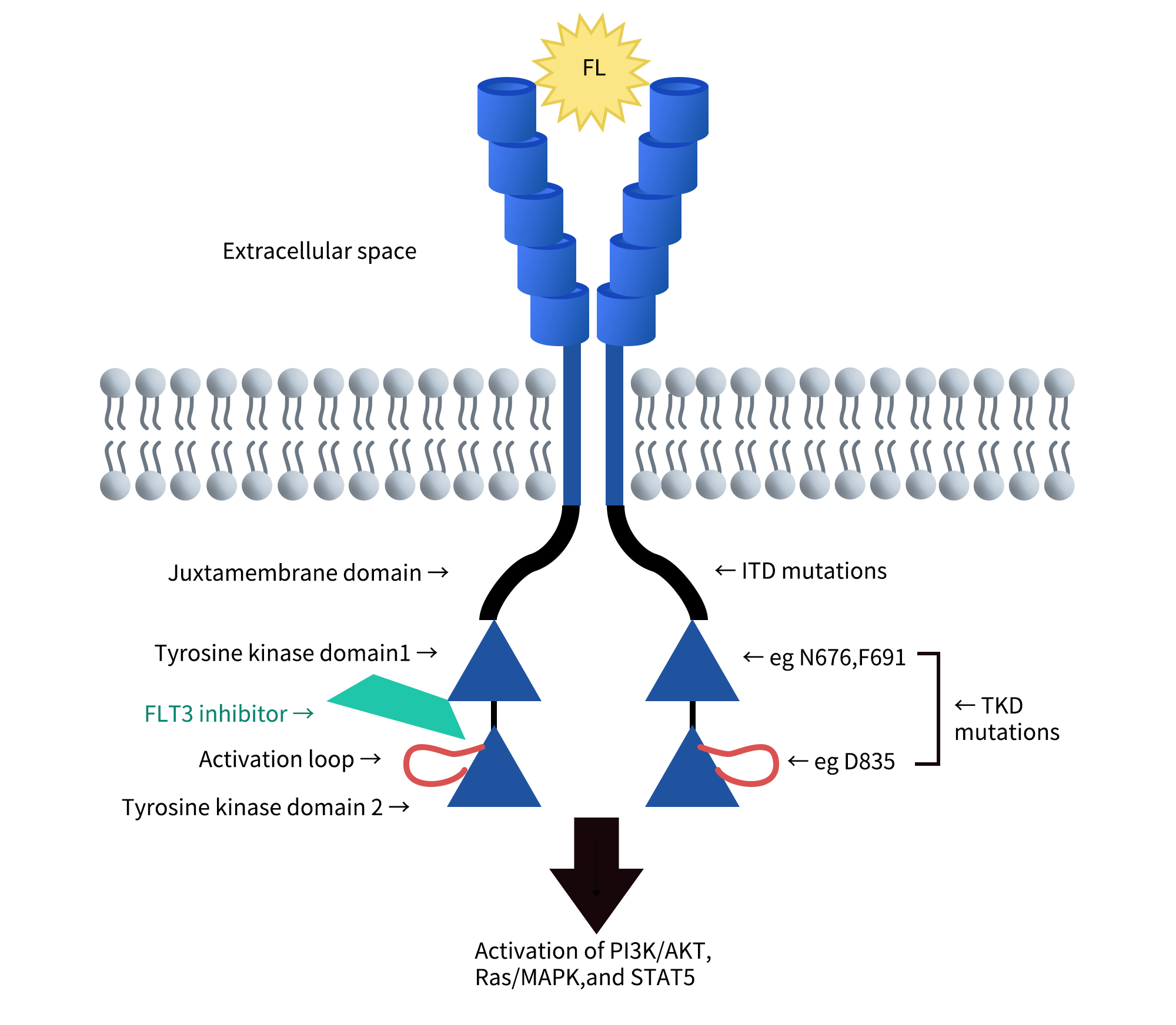
FMS样酪氨酸激酶3(FLT3)与KIT、FMS和血小板衍生生长因子受体(PDGFR)一起属于III类受体酪氨酸激酶(RTK)家族。
其结构包括:
- 细胞外结构域:由氨基末端的五个免疫球蛋白样区域组成,负责配体结合。
- 跨膜区:将受体锚定在细胞膜上,保证信号传导的稳定性。
- 细胞内膜旁结构域(JMD):在受体激活过程中发挥调节作用。
- 酪氨酸激酶结构域:由两个激酶结构域组成,并由激酶插入区隔开,是信号传导的重要部分。
FLT3主要在骨髓(BM)中的造血干细胞(CD34⁺细胞)和早期祖细胞中表达,并在树突状细胞祖细胞中发挥作用。此外,FLT3在胎盘、脑及睾丸等组织中也有表达,但其功能尚不完全清楚。
FLT3基因位于13号染色体的q12区域,包含24个外显子。其蛋白有两种形式:
- 膜结合形式(158-160 kDa):具有N连接的糖基化修饰。
- 细胞质形式(130-143 kDa):未经过糖基化修饰。
Cite from The biology and targeting of FLT3 in pediatric leukemia.
FLT3的天然配体FL(FLT3 ligand)主要由骨髓基质细胞表达,并以膜结合形式存在。FL与FLT3结合后,诱导受体二聚化和自磷酸化,随后激活细胞信号通路,调节未成熟造血细胞的增殖和分化。尽管FL本身的增殖刺激较弱,但它可与干细胞因子(SCF,C-KIT的配体)或其他细胞因子协同作用,增强祖细胞的扩增。此外,FL还能通过VLA-4和VLA-5诱导造血祖细胞粘附至基质细胞,在造血过程中发挥重要作用。目前,中枢神经系统中FLT3的确切功能仍不明确,仍需要进一步研究探索其生理作用及在疾病中的潜在影响。
2. FLT信号转导
FMS样酪氨酸激酶3(FLT3)是一种受体酪氨酸激酶,几乎完全在造血区室中表达。其配体FL诱导其内在酪氨酸激酶活性的二聚化和激活。 FLT3的激活导致其自磷酸化和几个信号转导级联的启动。信号传导是通过将信号转导分子募集到激活的FLT3中通过与特异性磷酸化酪氨酸残基在FLT3的细胞内区域结合而引发的。 FLT3的激活介导细胞存活,细胞增殖和造血祖细胞的分化。它与其他几种细胞因子的协同作用以促进其生物学作用。失控的FLT3活性与多种疾病有关,最突出的是急性髓样白血病,大约三分之一的患者携带激活的FLT3突变体,该突变体驱动该疾病,并且与预后不良相关。 FLT3的过度活动也与自身免疫性疾病(例如类风湿关节炎)有关。 FLT3的功能增益突变可以促进白血病发生的观察结果刺激了针对该受体的抑制剂的发展。其中许多是在临床试验中,有些已被批准用于临床使用。
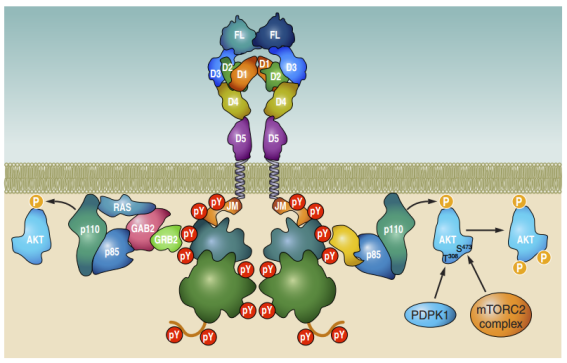
Cite from FMS-like Tyrosine Kinase 3/FLT3: From Basic Science to Clinical Implications.
3. FLT3临床药物
近年来,围绕FLT3开发的药物以小分子抑制剂为主,目前已上市药物有9款,均为小分子抑制剂,此外有部分最高临床阶段已进入临床III期。除小分子药物外,针对FLT3的细胞疗法(如CAR-T、TCR-T)、双特异抗体和蛋白降解类药物(如PROTAC)也在探索中,展示出良好的潜力。整体来看,FLT3仍是AML治疗中最具前景的靶点之一,药物研发管线丰富、技术路线多样。
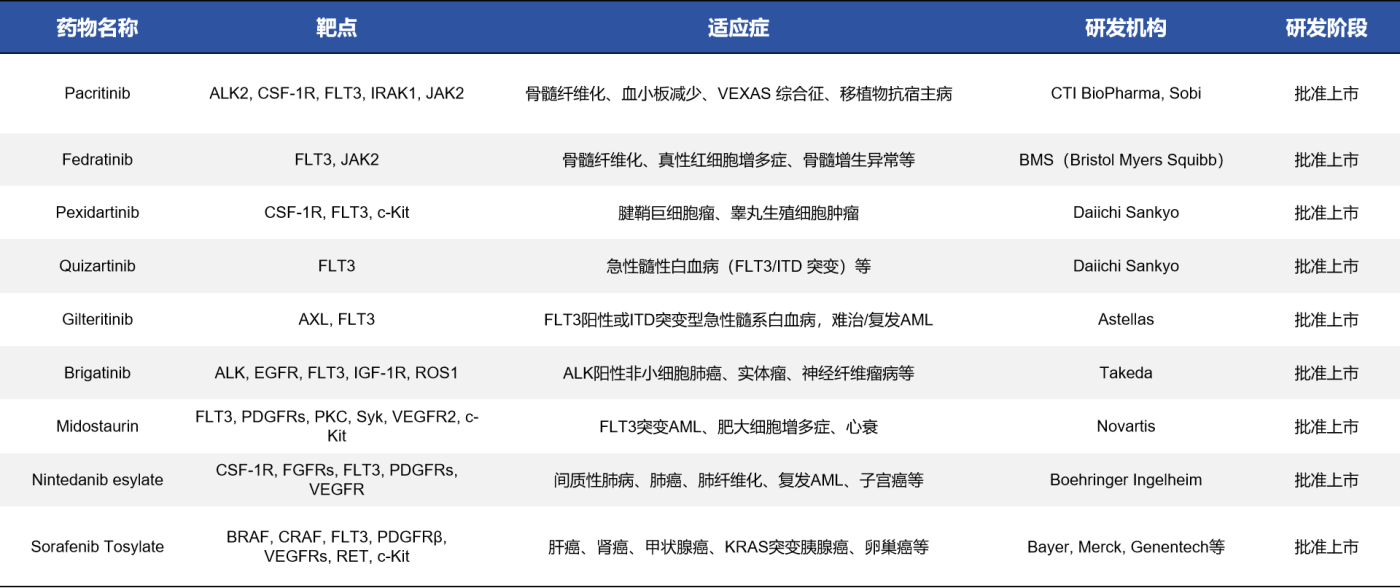
3.1 已批准上市的FLT3靶点相关药物
截至目前,已有9种具有FLT3抑制活性的药物在全球范围内获批上市,用于急性髓系白血病(AML)或其他肿瘤治疗。这些药物主要包括选择性FLT3抑制剂(如Gilteritinib、Quizartinib、Crenolanib)和多靶点酪氨酸激酶抑制剂(如Midostaurin、Sorafenib、Sunitinib、Lestaurtinib、Tandutinib、Fedratinib),其中前者靶向性更强,后者则同时作用于多个激酶(如VEGFR、PDGFR、KIT等)。它们多为ATP竞争性小分子抑制剂,通过抑制FLT3激酶的自磷酸化,阻断其下游信号通路(如STAT5、MAPK、PI3K/AKT),从而抑制白血病细胞的增殖与生存。这些药物的开发不仅提升了FLT3突变AML的治疗选择,也推动了精准靶向治疗的发展。
3.2 临床阶段的FLT3靶点相关药物
目前FLT3靶点相关的药物研发类型,涵盖小分子抑制剂、CAR-T细胞疗法及新兴的PROTAC降解剂三大方向。FLT3小分子抑制剂品种丰富,已有的像Crenolanib、Ruserontinib等多个候选药物进入临床中晚期阶段,显示出在FLT3突变型AML治疗中的核心地位。CAR-T疗法方面,虽尚处临床早期,但诸如SENTI-202等创新设计正努力突破靶点表达广泛带来的安全性挑战。在蛋白降解领域,LNK-01002作为首个进入临床的FLT3 PROTAC药物,体现出降解代替抑制的研发趋势。
3.2.1 小分子抑制剂
FLT3作为急性髓性白血病(AML)中的高频突变靶点,已成为小分子靶向药物开发的重点。据不完全统计,目前临床在研的FLT3靶点相关药物共有三十余种临床阶段的FLT3抑制剂。
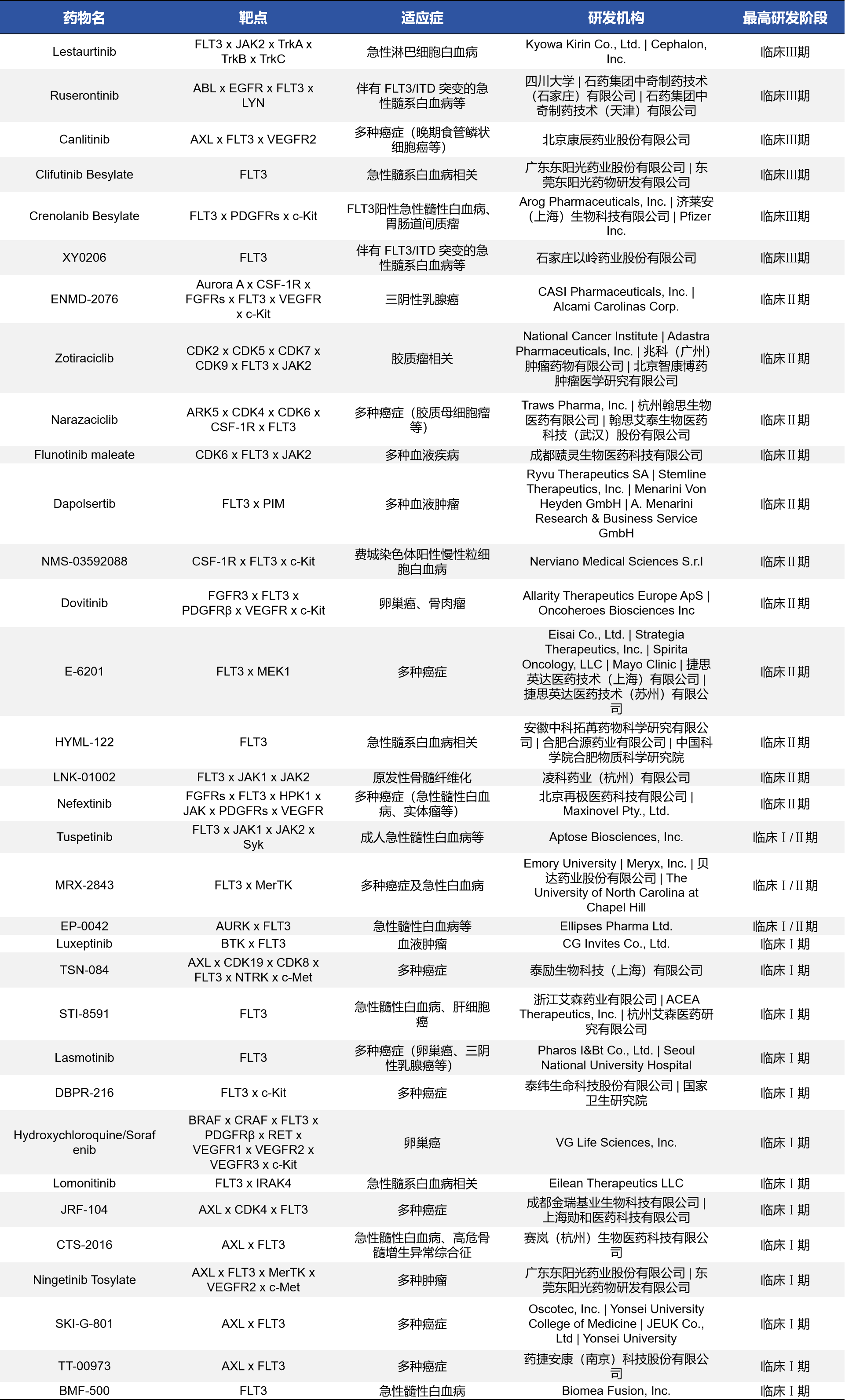
- Crenolanib(克瑞诺替尼):为第二代FLT3抑制剂,具备较强的对FLT3-ITD和FLT3-TKD突变的抑制活性,同时也作用于PDGFR和c-Kit等受体酪氨酸激酶。目前处于AML三期临床阶段,由Arog Pharmaceuticals牵头开发,疗效和耐药性方面表现优于第一代抑制剂Midostaurin。
- Ruserontinib(瑞舒替尼):由中国企业主导开发,具备多靶点特性,除FLT3外还作用于ABL、EGFR和LYN等。已进入三期临床,主要适应症为FLT3/ITD突变型AML,显示出较强的临床活性。
- ENMD-2076:具有多靶点活性(Aurora A、FLT3、VEGFR等),在三阴性乳腺癌(TNBC)中显示潜力,表明FLT3抑制剂也正从血液肿瘤拓展至实体瘤治疗。
这些药物的持续推进为FLT3阳性AML及其他相关疾病患者提供了更多治疗选择,同时也揭示了抑制剂代谢稳定性、靶向选择性和耐药机制等关键研究难点。
3.2.2 CAR-T细胞疗法
针对FLT3的CAR-T产品虽尚处早期,但在复发/难治AML治疗中显示出良好前景。目前FLT3靶向CAR-T细胞疗法共有4款在研药物。

- Anti-FLT3 CAR-T:针对FLT3阳性的AML患者,目前处于I/II期临床阶段。该产品可能结合靶向清除白血病干细胞与增强抗原特异性的设计理念。
- SENTI-202:由Senti Biosciences开发,采用逻辑门控制技术,靶向CD33与FLT3双靶点,增强治疗选择性并降低正常造血干细胞毒性。该创新设计有望改善传统CAR-T面临的“脱靶毒性”与“细胞因子风暴”问题。
尽管CAR-T产品在AML中面临造血系统抗原广泛表达导致的安全性挑战,但这些早期研究为未来开发FLT3靶向免疫细胞疗法提供了重要基础。
3.2.3 蛋白水解靶向嵌合体
仅目前仅有一款处于临床阶段的FLT3 蛋白水解靶向嵌合体(PROTAC)药物:

- LNK-01002:是一种双靶点PROTAC分子,同时降解FLT3与JAK1/2,适用于原发性骨髓纤维化等髓系疾病。该药物目前处于II期临床,可能通过诱导FLT3蛋白泛素化降解来克服传统抑制剂的耐药问题。
与传统激酶抑制剂相比,PROTAC药物可实现“靶点去除”而非“功能抑制”,有望为FLT3变异患者提供长期疗效与耐药解决方案。
4. 缔码FLT3靶点相关产品
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。现可提供一系列FLT3靶点的现货产品,产品包括重组蛋白、重组单克隆抗体及生物素/PE标记抗体。同时,我们还可以提供系统的服务,包括蛋白/抗体定制服务、抗体人源化、抗体亲和力成熟、稳转细胞株等。此外,我们已经建立了FLT3靶点的B细胞种子库,可在短短20天内筛选出客户所需的先导抗体分子。如需了解更多详情,欢迎垂询。(400-006-0995 / 18062749453)
• 蛋白&抗体
| Type | SKU | Product Name | |
| ECD Protein | PME100033 | Human FLT3 Ligand Protein, mFc-His Tag | |
| PME100007 | Human FLT3 Protein, hFc-His Tag | ||
| Monoclonal Antibodies | DMC100421 | Anti-FLT3LG antibody(DMC421); IgG1 Chimeric mAb | |
| DMC101110 | Anti-FLT3 antibody(19A5), IgG1 Chimeric mAb | ||
| PE-conjugated mAb | DMC101110P | PE-conjugated Anti-FLT3 antibody(19A5), IgG1 Chimeric mAb | |
| DMC100421P | PE-conjugated Anti-FLT3LG antibody(DMC421); IgG1 Chimeric mAb | ||
| Biotinylated mAb | DMC100421B | Biotinylated Anti-FLT3LG antibody(DMC421); IgG1 Chimeric mAb | |
| DMC101110B | Biotinylated Anti-FLT3 antibody(19A5), IgG1 Chimeric mAb | ||
- FLT3先导分子研究进度

参考文献:
- Annesley, C.E. and P. Brown, The Biology and Targeting of FLT3 in Pediatric Leukemia. Front Oncol, 2014. 4: p. 263.
- Naoe, T. and H. Kiyoi, Normal and oncogenic FLT3. Cell Mol Life Sci, 2004. 61(23): p. 2932-8.
- Kazi, J.U. and L. Ronnstrand, FMS-like Tyrosine Kinase 3/FLT3: From Basic Science to Clinical Implications. Physiol Rev, 2019. 99(3): p. 1433-1466.
- Daver, N., et al., Targeting FLT3 mutations in AML: review of current knowledge and evidence. Leukemia, 2019. 33(2): p. 299-312.
- Zhao, J.C., et al., A review of FLT3 inhibitors in acute myeloid leukemia. Blood Rev, 2022. 52: p. 100905.