上一篇我们重点介绍了减肥药热门靶点G蛋白偶联受体75(GPR75),本次的主题是另一个用于治疗成人肥胖的新兴靶点激活素2型受体(Activin A Receptor Type 2,ActRII)。区别于现今获批的减重药物,这些药物虽然能够使肥胖患者的体重下降,却也同时造成患者的肌肉丧失。这可能会老年人服用这种药物可能会变得虚弱,使其更容易发生意外。而靶向ActRII受体传导信号通路有望在驱动脂肪流失的同时,增加患者身体的肌肉组成。那ActRII究竟是什么?其具体的作用机理又是什么?目前有哪些药企巨头布局了这个靶点?
1、ActRII结构
ActRII属于较大的TGF-β受体家族,可调节转化生长因子β配体的信号。目前激活素II型受体有两种ACVR2A和ACVR2B,其中,ACVR2A(又称为ActRIIA)最早是由Mathews LS等人于1991年鉴定为为激活素A的跨膜丝氨酸/苏氨酸激酶 [1];ACVR2B(又称为ActRIIB)是由Harrison CA等人于2005年发现 [2]。ActRII的生物学功能与激活素I型受体(ActRI)是密不可分的,目前鉴定出来的激活素I型受体有7种,包括ALK1、ALK2、ALK3、ALK4、ALK5、ALK6和ALK7 [3]。两种类型的激活素受体均具有约500个氨基酸残基,都是单次跨膜丝氨酸/苏氨酸激酶,包括具有配体结合活性的富含 Cys 的胞外结构域(约110 个氨基酸残基)、一个跨膜结构域(约 26 个氨基酸残基)和一个胞内结构域(约 360 个氨基酸残基)组成。
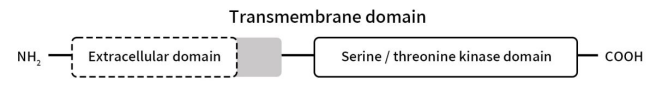
Figure 1. The structure of Activin A Receptors
与II型受体不同,I型受体在激酶结构域之前的细胞内近膜区域附近有一个独特的GS结构域。在配体结合复合物中,II型受体磷酸化I型受体GS区的丝氨酸和苏氨酸残基,然后进行信号传导 [4]。磷酸化将该区域从抑制剂FKBP12蛋白的对接位点转变为其底物Smad家族转录因子的对接位点 [5]。ActRII参与许多生理过程,包括生长、细胞分化、体内平衡、成骨、细胞凋亡和许多其他功能。
2、ActRII信号通路
如下图所示,激活素、肌肉生长抑制素(GDF8,Myostatin)和GDF11通过ActRII和ActRI触发信号传导。ActRII是主要的配体结合受体,它会以高亲和力结合配体形成配受体复合物;配体/ActRII复合物会进一步招募ActRI并与之结合;结合后,ActRI会被ActRII磷酸化并激活。Smad2和3是激活素/TGF-β特异性Smad,可由活化的ActRI磷酸化。在细胞核中,Smad2/3/4 复合物通过其他的转录辅因子调节基因表达。不依赖Smad的通路(例如MAPK)也在激活素受体的下游被激活。抑制素通过与ActRII和β聚糖形成高亲和力复合物来拮抗激活素。卵泡抑素、肌生长抑制素前肽和受体胞外域抑制细胞外空间中激活素和相关因子的活性,以防止配体/受体相互作用。
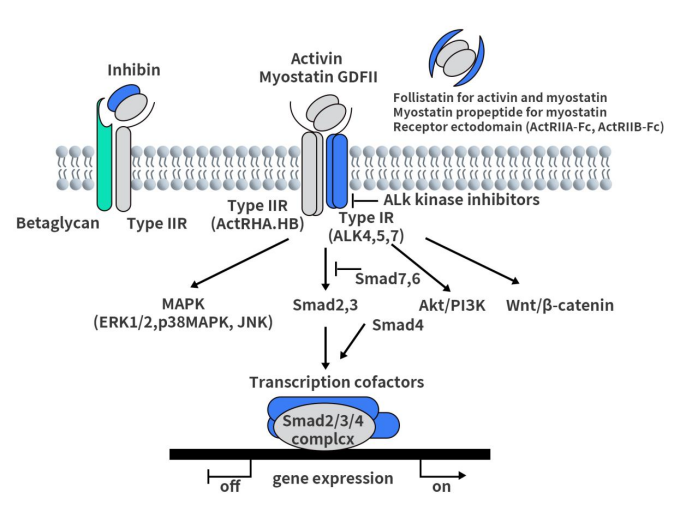
Figure 2. ActRII signaling pathway
激活素与ActRII结合后触发的信号是机体胚胎发育、器官形成、激素合成、细胞分化、免疫调节等重要生理活动的执行者。该通路的异常与多种疾病高度相关,包括代谢性和免疫性等多种疾病类型,如骨骼肌肉萎缩、肥胖、贫血、肺纤维化。以肥胖和心力衰竭为例,激活素通路可直接促进脂质储存和心肌细胞蛋白降解,最终导致内脏脂肪积累和心肌收缩受阻。
GDF8是 TGF-β 超家族成员,是肌肉生长的负调节因子。肌肉生长抑制素与ACVR2B结合,并在较小程度上与 ACVR2A 结合。GDF8/ActRII通路已被确定为调节骨骼肌大小的关键。
3、ActRII靶点临床研究进展
目前全球范围内约有2款ActRII蛋白产品上市,有6款ActRII产品进入到临床阶段,其中4款为ActRII蛋白,2款为抗体。
- Sotatercept
Sotatercept是由Acceleron研发的一款“first-in-class”的ActRIIA-Fc融合蛋白,早在2021年,该药物获得FDA授予的突破性疗法认定。2021年10月,默沙东以115亿美元收购Acceleron,获得Sotatercept。Sotatercept将ActRIIA经过改造的细胞外域与抗体的Fc端融合在一起。它可以阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。Sotatercept已于2024年3月26日获批FDA上市,用于治疗肺动脉高压(PAH)患者。
- Luspatercept
Luspatercept(罗特西普)是由BMS开发的一款ActRIIB-Fc融合蛋白,由人免疫球蛋白G1(IgG1)的Fc结构域与活化素受体IIB(ActRIIB)的细胞外结构域融合而成。2014年7月和8月,Luspatercept分别获得治疗β-地中海贫血中间型和重度和骨髓增生异常综合征(MDS)的孤儿药资格认定。2019年11月,Luspatercept首次获FDA批准上市,用于治疗需要定期输注红细胞(RBC)的成人β-地中海贫血;次年4月,Luspatercept被FDA批准用于低危MDS成人患者相关的贫血治疗。
- Bimagrumab
Bimagrumab最早是由诺华和MorphoSys开发的一款靶向激活素Ⅱ型A/B(ActRⅡA/B)的单克隆抗体,通过结合ActRⅡA/B来阻断ActRⅡA/B信号通路传导,具有治疗肌肉萎缩和肥胖症的潜力。2016年针对包涵体肌炎的三项临床试验NCT01925209、NCT02573467、NCT01669174表明,bimagrumab未能明显改善患者的6MWD、肌肉力量和握力,只是单纯的增加肌肉量,这无疑是给bimagrumab浇上了一盆冷水。
2017年2月,一项关于bimagrumab针对患有肥胖和II型糖尿病患者的临床II期研究(NCT03005288)的开展,让bimagrumab的商业前景重新被看好,也为2023年礼来收购Versanis Bio奠定基础。因为,礼来明确表示这一收购的主要目的是Versanis的先导管线bimagrumab。目前在临床上该药主要开发肥胖适应症。
- KER-012
KER-012是由美国生物技术公司Keros Therapeutics开发的一款蛋白质治疗候选产品,由与人类抗体Fc结构域部分融合的ActRIIB的修饰配体结合结构域组成。KER-012被设计用于结合并抑制包括激活素A和激活素B在内的TGF-β配体的信号转导,从而潜在地增加骨骼质量。同时,KER-012介导的对激活素A和激活素B的抑制也具有增加BMP信号通路的潜力。目前,Keros正在针对KER-012开展一项探讨KER-012联合背景疗法治疗成人肺动脉高压(PAH)的安全性和有效性的研究(NCT05975905)。该项临床研究是一项临床II期研究,目前正处于招募状态,针对的适应症为PAH。
- KER-050
KER-050是由Keros Therapeutics开发的一种工程化配体陷阱,由ActRIIA的修饰配体结合域与人类抗体Fc结构域部分融合组成。该融合蛋白旨在通过抑制TGF-β家族蛋白的一部分信号传导来促进造血作用来增加红细胞和血小板的产生。目前,Keros正在针对KER-050在临床上开展2项II期临床研究(NCT04419649和NCT05037760),对应的适应症分别为:骨髓增生异常综合症&血球减少和骨髓纤维化。两项临床研究当前均处于招募状态。
- LAE102
LAE102是由来凯医药开发的一款针对ActRIIA的单克隆抗体,具有对肿瘤生长、免疫激活、造血发育等有调控作用。来凯医药对于LAE102最早的定位是癌症治疗领域的核心管线之一。针对LAE102的肿瘤临床试验分别于2023年5月和2024年2月获得FDA和CDE批准。今天3月11日,来凯医药宣布已向FDA递交LAE102减肥适应症临床试验申请,完成中美双报。此消息一出,来凯医药的股价实现翻倍增长。
4、缔码生物ActRII相关产品及服务助力ActRII生物药研究
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。针对ActRII,缔码生物已开发人ACVR2A和ACVR2B重组蛋白产品,这些蛋白产品均利用哺乳动物表达系统重组表达,最大程度保留蛋白功能,如需定制其他种属蛋白及相关抗体服务,欢迎留言咨询。此外,缔码拥有以下四大特色技术平台,可为先导分子开发提供技术支持。
- DiMPro™功能性膜蛋白开发平台 (ECD, Synthetic Nanodisc, VLP);
- DimAb单B细胞先导抗体分子发现平台(已经完成400+药靶,5000+兔单抗分子的开发)
- DiLibrary™抗体工程改造平台(抗体人源化、抗体亲和力成熟、PTM去除等)
- 抗体功能验证平台(CAR-T、ADC抗体功能评估等)
| 靶点 | 产品货号 | 产品名称 |
| ACVR2A | PME101550 | Human ACVR2A Protein, hFc Tag |
| ACVR2B | PME101551 | Human ACVR2B Protein, hFc Tag |
| BME100228 | Anti-ACVR2B(bimagrumab biosimilar) mAb |
参考文献:
[1] Mathews LS, Vale WW: Expression cloning of an activin receptor, a predicted transmembrane serine kinase. Cell. 1991, 65: 973-982.
[2] Harrison CA, Gray PC, Vale WW, Robertson DM: Antagonists of activin signaling: mechanisms and potential biological applications. Trends Endocrinol Metab. 2005, 16: 73-78.
[3] Feng XH, Derynck R: Specificity and versatility in tgf-beta signaling through Smads. Annu Rev Cell Dev Biol. 2005, 21: 659-693.
[4] J.L. Wrana, L. Attisano, R. Wieser, F. Ventura, J. Massague, Mechanism of activation of the TGF-beta receptor. Nature, 370, 6488 (1994), 341– 347.
[5] M. Huse, T.W. Muir, L. Xu, Y.G. Chen, J. Kuriyan, J. Massague, The TGF beta receptor activation process: an inhibitor- to substrate-binding switch. Mol. Cell, 8, 3 (2001), 671– 682.
