PD-1/PD-L1肿瘤免疫调节的药物通过阻止PD-1和PD-L1的识别过程,解除肿瘤细胞对免疫系统的逃逸,部分恢复T细胞功能,从而使T细胞可以杀死肿瘤细胞。
PD-1/PD-L1药物在肿瘤免疫治疗取得了革命性的成功。但是肿瘤微环境中浸润的大量的免疫抑制性细胞(比如Treg细胞),使得不同类型肿瘤患者对PD-1/PD-L1肿瘤免疫疗法的应答率较低。
FOXP3+调节性T细胞(Regulatory T cells, treg)在介导自身抗原耐受中发挥关键作用,并通过多种机制抑制抗肿瘤免疫。因此,靶向清除肿瘤微环境 (tumor microenvironment, TME) 的treg可以促进有效的抗肿瘤免疫,同时保持周围环境的稳态。
1、CCR8
CCR8(Chemokine receptor 8)是一种七跨膜G蛋白偶联受体,属于趋化因子受体C-C亚家族。CCR8在Th2细胞、单核细胞和NK细胞上有表达,在Th1细胞上不表达。此外,CCR8在Treg细胞中也有表达,在肿瘤浸润的Treg细胞中高表达,在胸腺、脾脏和外周血的Treg细胞中表达量较低。CCR8通过与其配体的相互作用参与了多种肿瘤的发展进程以及介导了肿瘤的免疫。肿瘤部位的Treg上的CCR8特异性高表达表明CCR8是肿瘤部位的Treg细胞的非常好的生物标志物,是极具潜力的肿瘤免疫靶点。
2、CCR8配体
人类CCR8有四种已知配体:CCL1、CCL8、CCL16和CCL18。CCR8是目前已知CCL1的唯一受体。
CCL1-CCR8在癌症中的意义
人CCL1是人CCR8的主要配体,同时与CCR8细胞外环2 (ECL2)和CCR8的N端结构域结合。(图1)
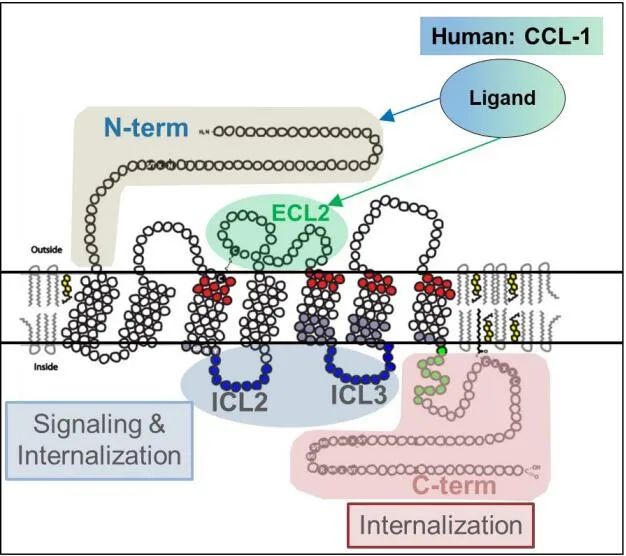
图1 (数据来源:F Dépis et al. Proceedings: AACR Annual Meeting 2020)[1]
在肿瘤微环境中,由肿瘤干细胞,CAF(carcinoma-associated fibroblasts)和TAM(tumor-associated macrophages)分泌的CCL1通过作用于不同细胞表面的CCR8受体,发挥其功能:
1. CCL1激活癌细胞上的CCR8受体,导致癌细胞的增殖、凋亡抗性和迁移。
2. 除了对癌细胞的作用外,CCL1通过激活内皮细胞上的CCR8受体引起血管生成。
3. CCL1另一个重要功能是募集Treg到肿瘤生态位,并参与了CD4+ T细胞向Treg的转化。
CD4+ T细胞向Treg的转化过程依赖于转化生长因子-β (transforming growth factor-β, TGF-β)。CCL1支持Treg在肿瘤生态位中的免疫抑制功能。阻断CCL1-CCR8轴作为一种新的基于免疫检查点的恶性肿瘤治疗方法。
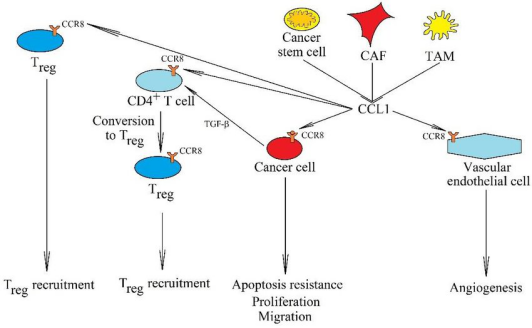
图2 (数据来源:Korbecki J et al. International Journal of Molecular Sciences, 2020)[2]
CCL18-CCR8在癌症中的意义
在肿瘤中,CCL18由TAM产生和分泌,它以自分泌的方式作用于这些细胞。
它还通过受体PITPNM3和CCR8引起癌细胞迁移和侵袭。CCL18通过作用于内皮细胞上的PITPNM3而在血管生成中起重要作用。它还导致naïve CD4+ T细胞进入肿瘤生态位和 CD4+ T细胞向Treg细胞的转化。
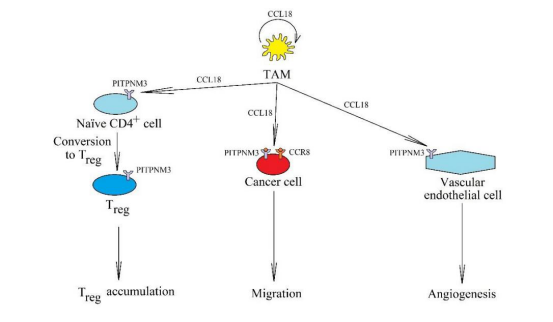
图3 (数据来源:Korbecki J et al. International Journal of Molecular Sciences, 2020)[2]
3、CCR8和Treg细胞介导的免疫抑制
CCR8+调节性T细胞(Treg细胞)是免疫抑制的驱动因子。CCR8是一种免疫抑制性受体,介导了肿瘤细胞的免疫逃逸。CCR8介导的Treg细胞的免疫抑制作用大致如下:
CCL1能够通过与其配体CCR8的相互作用招募FOXp3+CCR8+Treg细胞浸润到肿瘤组织中,行使免疫抑制功能,同时可以诱导FOXp3+Treg细胞表面CCR8表达上调,诱发Ca2+流动,诱导stat3依赖性的Foxp3、CD39、IL-10和颗粒酶B表达上调,进而增强这些肿瘤浸润的Treg细胞的免疫抑制活性。
CCR8在患者肿瘤组织中的FOXP3+ Tregs上高表达,而在患者血液中显著降低。这与CCR4、CTLA-4和CD25等靶点不同,它们在肿瘤和血液的Treg上的表达差异不大(图4)。CCR8在肿瘤部位Treg细胞上的特异性表达,使得开发CCR8靶向性的单克隆抗体药物则有望特异性地抑制肿瘤部位的Treg的功能,有助于癌症治疗。
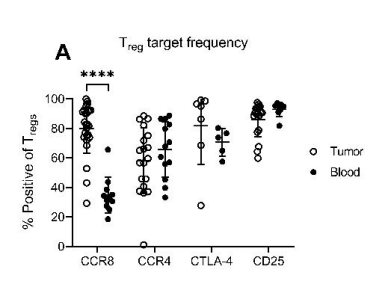
图4 (数据来源:Campbell Joseph R et al. Cancer Res, 2021)[3]
但是实验表明,CCR8的存在与否并不影响Treg的迁移能力以及在肿瘤微环境中的功能。在2021年发表在Cancer Research上的文章“Fc-optimized anti-CCR8 antibody depletes regulatory T cells in human tumor models”也得出类似的结论。
该研究中,为了确定CCR8阻断相对于抗体介导的Treg细胞耗竭在抗肿瘤免疫中的相对贡献,用anti-mCCR8-IgG2a(Fc区域为强ADCC)和anti-mCCR8-IgG1-D265A(Fc区域为弱ADCC)治疗MC38肿瘤小鼠。抗mCCR8-IgG2a治疗可诱导明显的肿瘤消退,而抗CCR8-mIgG1-D265A治疗对肿瘤生长无明显影响(图5A)。重要的是,在使用抗anti-mCCR8-IgG2a治疗后,肿瘤中treg的频率降低了75%(图5B)。
由此表明,开发CCR8治疗性抗体,其作用机理不应该是单纯的功能阻断,还通过ADCC效应耗竭肿瘤浸润的FOXp3+CCR8+Treg细胞以增强抗肿瘤免疫。目前,百时美施贵宝(BMS)和吉利德(Gilead Sciences)的CCR8抗体都是去岩藻糖基化以增强ADCC。

图5A(数据来源:Campbell Joseph R et al. Cancer Res, 2021)[3]
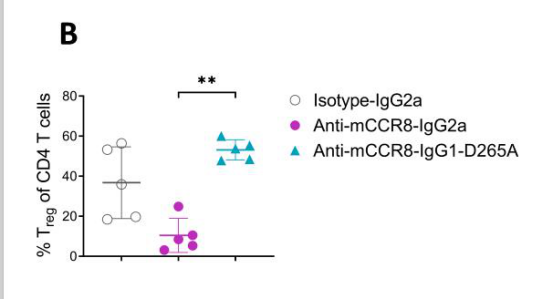
图5B(数据来源:Campbell Joseph R et al. Cancer Res, 2021)[3]
4、针对CCR8靶点的药物研究
下表是有关CCR8靶点的药物,作用机制以及相关公司:
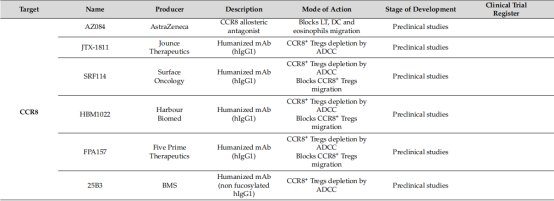
(数据来源Cinier Justine et al. Cancers (Basel), 2021)[4]
BMS-986340—百时美施贵宝(BMS)
这是全球第一款正式开启临床研究的CCR8靶向性抗体药物(试验登记号:NCT04895709)。
2021年5月份,BMS就CCR8靶向性单克隆抗体BMS-986340启动了一项新的1/2期临床,评估其与O药联用对多种实体瘤的治疗效果。
JTX-1811(GS-1811)—吉利德
JTX-1811是一种靶向CCR8的单克隆抗体,该项目已经获得了FDA的临床试验许可(试验登记号:NCT05007782)。当JTX-1811与CCR8结合后时,它可以通过增强的抗体依赖性细胞毒性机制靶向清除具有免疫抑制能力的肿瘤浸润性调节性Treg细胞以增强抗肿瘤免疫。
2020年9月,吉利德(Gilead Sciences)从Jounce Therapeutics获得JTX -1811项目的独家授权。

(JTX-1811耗尽高CCR8表达的肿瘤浸润性treg细胞)(数据来源:Jounce Therapeutics Inc)
SPF114—Surface Oncology
SRF114是一种人IgG1抗CCR8的单抗,靶向肿瘤Treg细胞,并通过活化NK细胞诱导抗体依赖性细胞介导的细胞毒作用(ADCC),从而达到选择性消耗免疫抑制性肿瘤T调节细胞(Tregs),并同时保留外周Tregs的目的。
2021年2月,Surface Oncology从Vaccinex获得SRF114权益。目前,该项目处于临床前阶段。
(数据来源:Surface Oncology官网)
HBM1022—和铂医药
2020年9月,和铂医药展示其针对CCR8靶点开发的单克隆抗体HBM1022的研究,显示该单抗具有良好的抗肿瘤功能并与食蟹猴CCR8存在交叉反应,与CCR8特异性结合清除肿瘤微环境内的Treg细胞,呈现出显著的抗肿瘤效果,及与抗PD-1抗体具有潜在的良好协同作用。此外,HBM1022还能阻断CCR8与其配体CCL1的结合,同时抑制CCL1介导的肿瘤微环境内TIL-Treg的功能。
IPG7236—艾美斐医药
IPG7236是艾美斐医药自主研发的靶向CCR8的小分子抑制剂。CCR8小分子抑制剂不仅能够抑制肿瘤细胞转移,也可以抑制肿瘤相关Treg细胞向肿瘤组织浸润,从而逆转肿瘤免疫抑制性微环境,增强抗肿瘤免疫反应。临床前研究显示,IPG7236能高效阻断肿瘤微环境中Treg浸润、扩增、降低其免疫抑制性,具有广谱抗肿瘤作用,且安全性极高。于2021年8月14日获得美国FDA批准临床试验申请(IND),将在美国启动临床试验。
FPA-157—Amgen Inc
FPA157是一种靶向CCR8的单克隆抗体,旨在增强抗体依赖的细胞介导的细胞毒性(ADCC),并耗尽肿瘤微环境中的T调节细胞(Treg)种群。临床前数据表明FPA157作为一种新型免疫调节剂,有可能消除实体肿瘤中treg介导的免疫抑制。
FPA157是安进免疫肿瘤抗体生产线的一部分,目前处于临床前阶段。
除此之外,还有一些针对CCR8的研究,比如普米斯正开发的CTLA-4/CCR8双抗以及联合用药。
目前,缔码生物已成功完成CCR8功能抗原制备,CCR8参照抗体制备。
| 产品类型 | 产品货号 | 产品名称 |
| ECD重组蛋白 | PME101103 | Human CCR8 Protein, mFc Tag |
| PME101091 | Human CCR8 Protein, hFc Tag | |
| PME-C100006 | Cynomolgus CCR8 Protein, hFc Tag | |
| PME-M100034 | Mouse CCR8 Protein, hFc Tag | |
| 全长蛋白 | FLP100001 | Human CCR8 full-length protein-MNP |
| FLP100037 | Human CCR8 full-length protein-synthetic nanodisc | |
| FC验证抗体 | DME100180 | Anti-CCR8 antibody(DM180); Rabbit mAb |
| DME100195 | Anti-CCR8 antibody(DM195); Rabbit mAb | |
| DME100196 | Anti-CCR8 antibody(DM196); Rabbit mAb | |
| DME100197 | Anti-CCR8 antibody(DM197); Rabbit mAb | |
| 参照抗体 | BME100063 | Anti-CCR8(10A11) mAb |
| BME100115 | Anti-CCR8(BMS 986340) mAb | |
| 生物素标记抗体 | DME100180B | Biotinylated Anti-CCR8 antibody(DM180); Rabbit mAb |
| DME100195B | Biotinylated Anti-CCR8 antibody(DM195); Rabbit mAb | |
| DME100196B | Biotinylated Anti-CCR8 antibody(DM196); Rabbit mAb | |
| DME100197B | Biotinylated Anti-CCR8 antibody(DM197); Rabbit mAb | |
| BME100063B | Biotinylated Anti-CCR8(10A11) mAb | |
| BME100115B | Biotinylated Anti-CCR8(BMS 986340) mAb |
参考资料:
[1] F Dépis, Hu C , Weaver J , et al. Abstract 4532: Preclinical evaluation of JTX-1811, an anti-CCR8 antibody with enhanced ADCC activity, for preferential depletion of tumor-infiltrating regulatory T cells[C]// Proceedings: AACR Annual Meeting 2020; April 27-28, 2020 and June 22-24, 2020; Philadelphia, PA. 2020. [2] Korbecki J , Grochans S , Gutowska I , et al. Cc chemokines in a tumor: A review of pro-cancer and anti-cancer properties of receptors ccr5, ccr6, ccr7, ccr8, ccr9, and ccr10 ligands[J]. International Journal of Molecular Sciences, 2020, 21(20):1-34. [3] Campbell Joseph R,McDonald Bryan R,Mesko Paul B et al. Fc-Optimized Anti-CCR8 Antibody Depletes Regulatory T Cells in Human Tumor Models.[J] .Cancer Res, 2021, 81: 2983-2994. [4] Cinier Justine,Hubert Margaux,Besson Laurie et al. Recruitment and Expansion of Tregs Cells in the Tumor Environment-How to Target Them?[J] .Cancers (Basel), 2021, 13: undefined

