2022年6月18日,华尔街日报援引知情人士消息称,默沙东正考虑收购ADC领军公司Seagen。受此消息影响,Seagen盘中股价最大涨幅一度超过18%。截至收盘,该公司大涨12.7%,市值回到300亿美元以上。

早在2020年9月,默沙东引进Seagen的LIV-1 ADC新药Ladiratuzumab Vedotin,同时对Seagen进行10亿美元的股权投资。
Ladiratuzumab Vedotin
ladiratuzumab vedotin也被称为SGN-LIV1A和anti-LIV-1 ADC,是一种人源化抗体,使用Seagen专有的抗体药物偶联(ADC)技术靶向LIV-1。在LIV-1阳性肿瘤细胞给药和内化后,ladiratuzumab vedotin经过酶切释放MMAE到细胞质中。

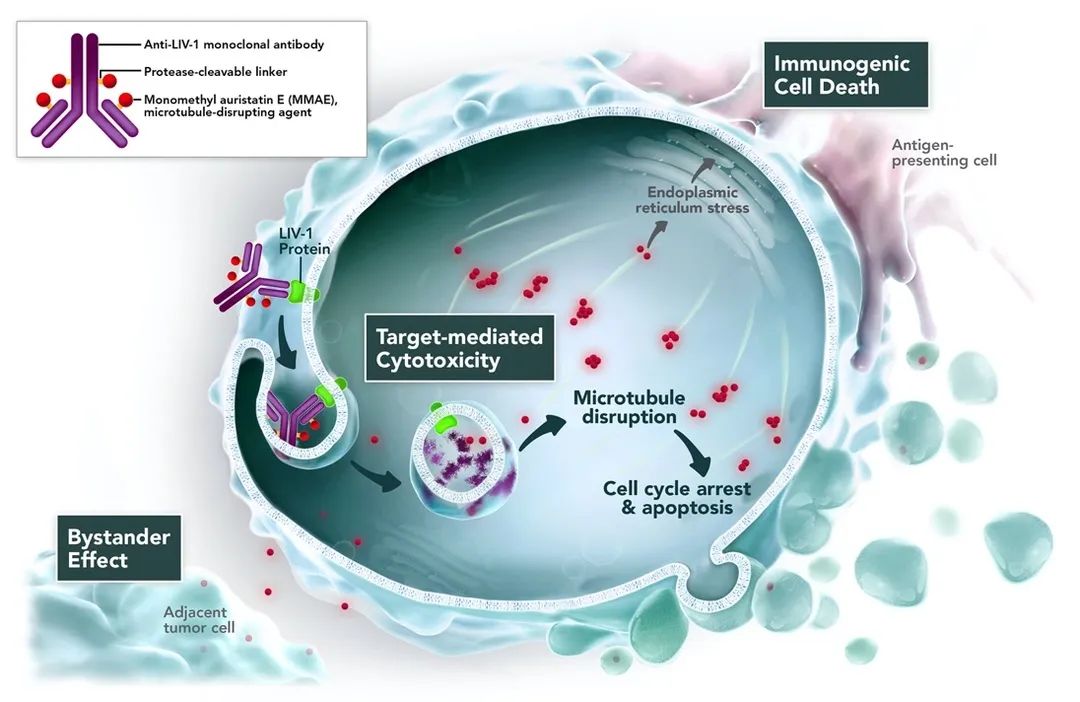
数据来源:https://www.seagen.com/science/pipeline/ladiratuzumab-vedotin
LIV-1
LIV-1分子别名SLC39A6, ZIP6, Zinc transporter ZIP6。它属于锌转运蛋白SLC39A家族(又称ZIP家族)。LIV-1 (ZIP6)在1988年首次被描述为雌激素调节基因。LIV-1与ZIP家族的其他成员一起,负责将细胞外或细胞器内的锌转运到细胞质。通过控制细胞质中锌浓度,LIV-1在细胞生长,胚胎发育中发挥重要作用。同时它也可通过促进上皮-间质细胞转化(EMT)来促进肿瘤的转移。
LIV-1的结构
SLC39A6蛋白属于LIV-1亚家族。该亚家族是由8个高度保守的跨膜结构域蛋白组成的,氨基和羧基端位于细胞质外。
该亚家族的共同特征
1. 位于跨膜结构域III和IV之间的长环区域。这个区域被称为可变区域,因为它的长度和序列在家族成员中几乎没有保守性。
2. III和IV之间的可变区域的一个特征是存在许多组氨酸残基,这是ZIP蛋白所共有的。它是一个潜在的金属结合域,它在许多ZIP蛋白中的保守性表明它在金属离子运输或调控中起作用。
3. ZIP蛋白中最大程度的保守性发现在跨膜结构域IV-VIII。
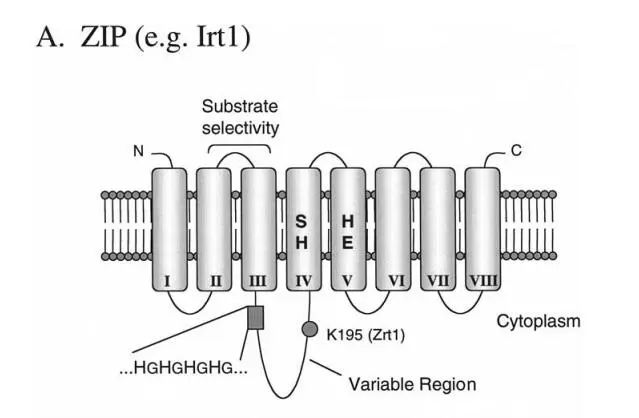
数据来源:Eukaryotic zinc transporters and their regulation.
LIV-1的表达
ZIP6最早作为雌激素调节基因被发现存在于淋巴结累及的乳腺癌中。此外,LIV-1也在黑色素瘤、前列腺癌、卵巢癌、子宫癌和宫颈癌中表达。LIV-1在多种肿瘤细胞中高表达而在正常组织有限表达,使得它成为一个有效的肿瘤治疗的靶点。
LIV-1作用机制
正如前面所提到的,作为锌离子转运体,LIV-1在正常细胞生长发育以及肿瘤的转移中发挥重要作用,LIV-1功能的实现依赖于细胞质中的锌离子。
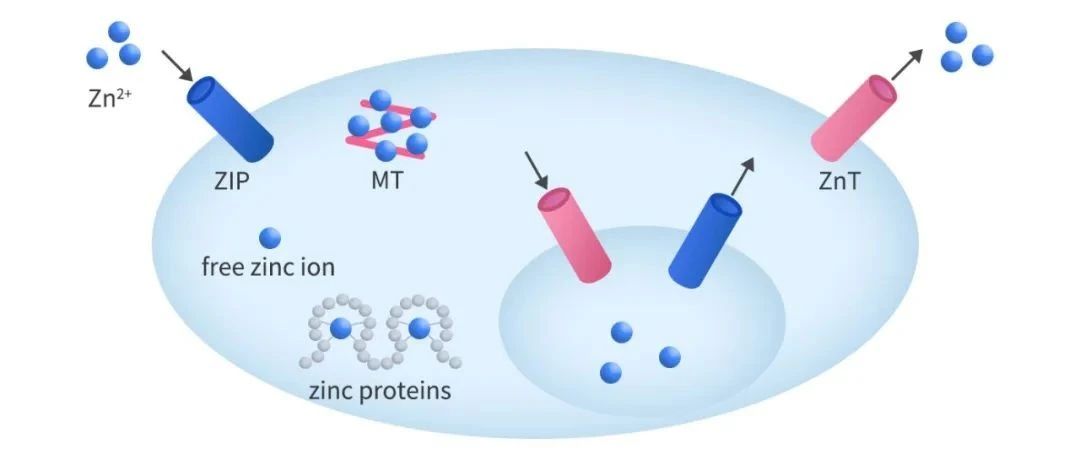
锌在细胞生存过程中起着至关重要的作用,包括信号转导、基因表达、减数分裂、免疫功能、凋亡控制和细胞周期进程。锌在细胞内稳态的控制主要依赖于转运蛋白ZIP家族和ZnT家族的共同调控。ZnT家族,能有效地降低了细胞质中锌的浓度。该家族在锌从细胞质流出细胞,以及锌从细胞质转到细胞器中发挥作用。
LIV-1与细胞分裂:ZIP6通过在细胞膜上形成的ZIP6/ZIP10异聚体将锌离子转运进入细胞内,从而触发有丝分裂,锌是细胞分裂所必需的。当锌内流进入细胞质的通道ZIP6/ZIP10异聚体被特异性抗体阻断时,有丝分裂被阻断。具体过程如下图:
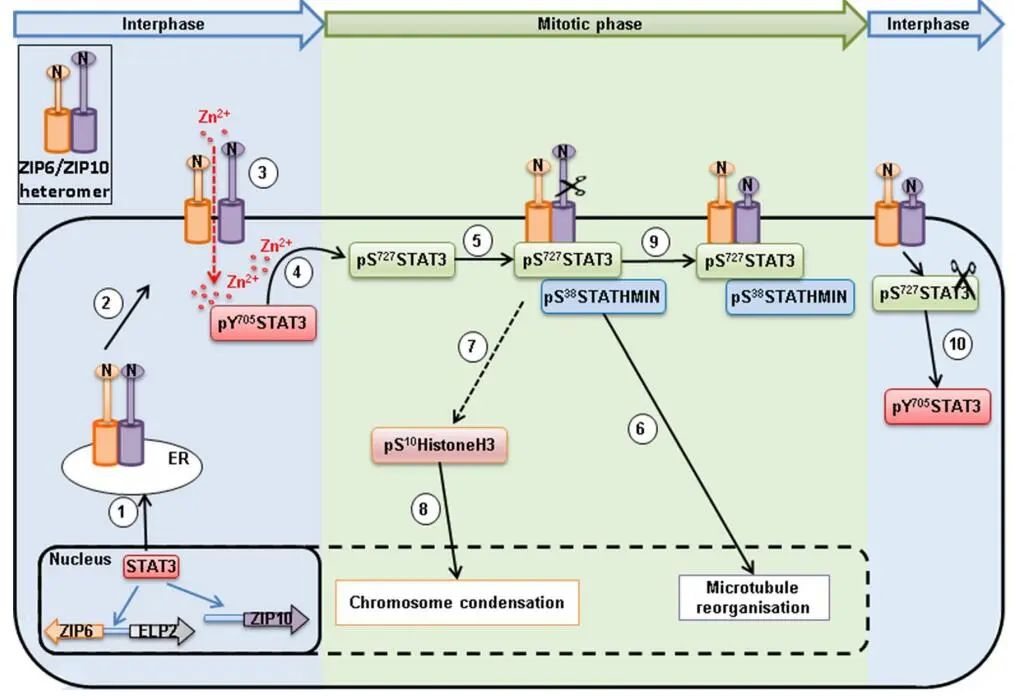
锌触发有丝分裂的原理图
(数据来源:The ZIP6/ZIP10 heteromer is essential for the zinc-mediated trigger of mitosis.)
由STAT3诱导表达的ZIP6位于内质网膜上,在那里它与ZIP10形成异聚体。合适的刺激使ZIP6 N端断裂并移位到质膜上。定位于质膜上的ZIP6/ZIP10异聚体导致细胞圆形,锌进入细胞。锌离子改变了STAT3的磷酸化状态,将pY705STAT3转化为pS727STAT3,并与ZIP6/ZIP10结合形成异聚体。pS38Stathmin结合pS727STAT3作为ZIP6/ZIP10复合体的一部分,驱动微管重组(微管重组是有丝分裂所需的),激活pS10HistoneH3,导致染色体凝聚。在有丝分裂结束时,STAT3的C端被切割,去除Ser727,Tyr705磷酸化并恢复STAT3的转录活性。
LIV-1与肿瘤细胞迁移:EMT是胚胎发育、组织重塑以及损伤修复等正常生理活动中必不可少的过程,也是原肠形成和癌症转移过程中的一个基本事件,它使单个细胞失去其细胞粘附,导致细胞圆绕和分离,因此可促进肿瘤的转移。
ZIP6在上皮-间充质转化(EMT)中具有重要促进作用,为预测临床肿瘤扩散提供了一个新的靶点,并提示了一种依赖于ZIP6的肿瘤转移机制。ZIP6促进EMT涉及转录因子STAT3和Snail。其主要信号通路如下:
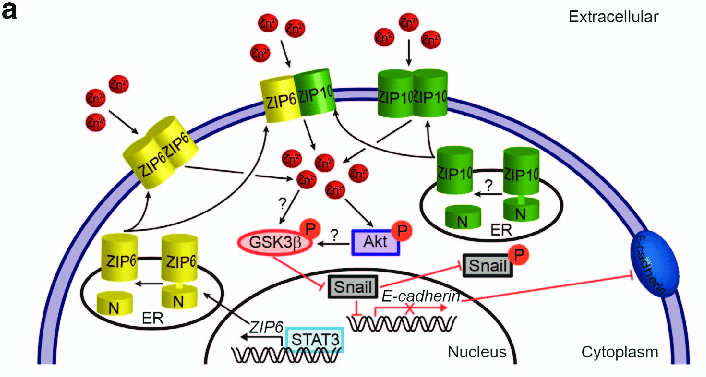
管腔上皮乳腺癌细胞中ZIP6/ zip10介导的信号通路
数据来源:The emerging role of zinc transporters in cellular homeostasis and cancer.
锌转运蛋白ZIP6由STAT3转录诱导的,表达于ER膜上。并通过N端断裂激活,ZIP6转位到质膜。ZIP10可能经历同样的翻译后处理,导致质膜定位。
在质膜上,ZIP6和ZIP10以同质和异质的形式存在并介导锌内流进入细胞质。内流进入的锌会直接使GSK-3β(糖原合酶激酶3β)因磷酸化失活,或间接地通过Akt使GSK-3β失活。失活的GSK-3β无法磷酸化Snail转录因子,导致Snail滞留在核内。Snail是E-钙粘蛋白(E-Cadherin)的转录抑制因子,它通过抑制E-cadherin的表达和促进间充质性状基因(如vimentin)的表达在EMT中发挥重要作用,导致细胞粘附性丧失,促进细胞的迁移。因此ZIP6在肿瘤细胞中的高表达促进了肿瘤细胞的转移。
LIV-1相关产品
为助力药企的药物研发,针对可成药靶点,缔码生物提供功能活性蛋白,参照抗体,和临床前先导抗体分子。极大提高药物研发的速度,并降低药企药物研发的风险。
对于靶点LIV-1,缔码生物应用哺乳动物表达系统,已开发其功能蛋白。

Figure 1. Human LIV-1 Protein, His Tag on SDS-PAGE under reducing condition.
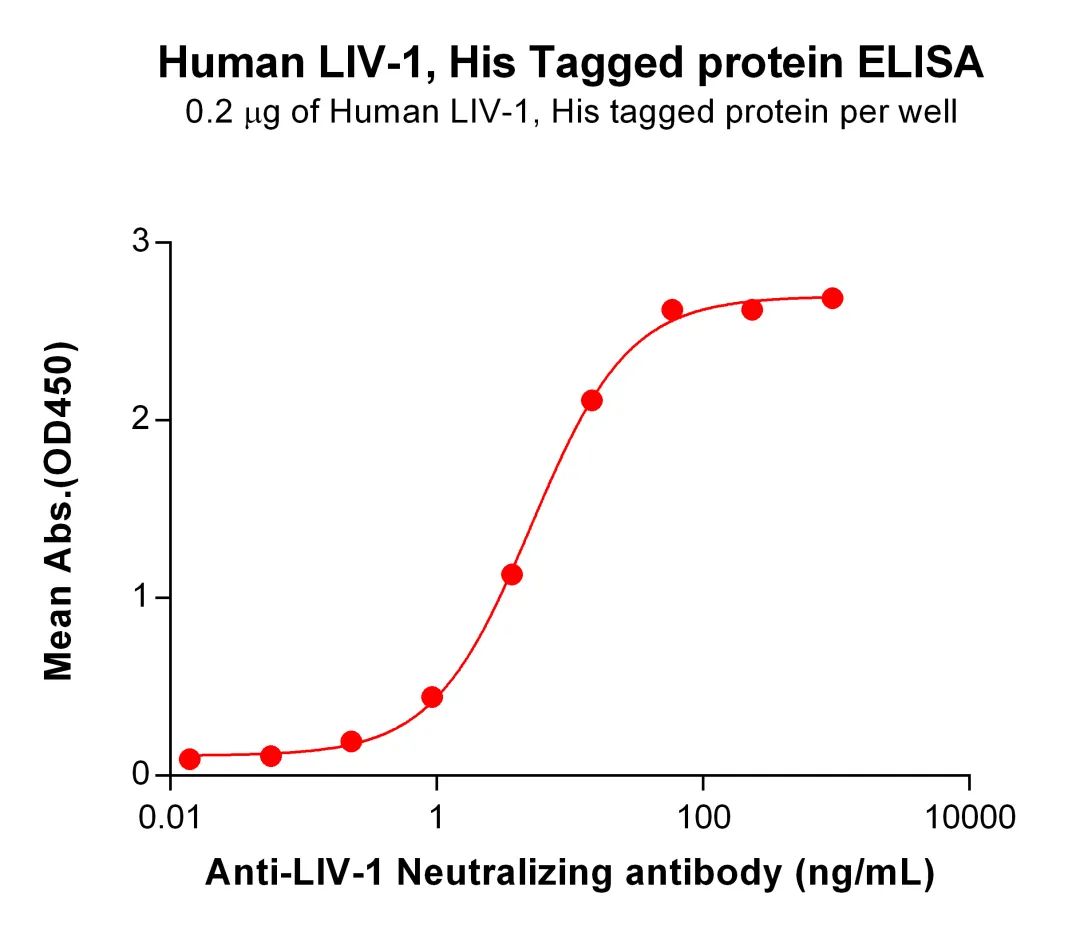
Figure 2. ELISA plate pre-coated by 2 μg/mL (100 μL/well) Human LIV-1 Protein, His Tag (PME100759) can bind Anti-LIV-1 Neutralizing antibody (BME100113) in a linear range of 0.92–58.59 ng/mL.
DimAb®先导抗体分子
基于独创的DimAb®重组单克隆抗体制备平台构建的DimAb®先导抗体分子均经过测序及流式/ELISA验证,可以直接进行成药性测试。客户无需等待,也无需承担任何风险即可获得具有成药性的先导抗体分子,加速药物研发进程。
针对以下可成药靶点,缔码生物已开发其先导分子,以“现货”的形式向客户提供先导抗体分子。与传统CRO公司相比,我们帮客户节约了抗体发现所耗费的时间,同时也承担了抗体发现过程中可能的风险。

关于缔码
缔码生物科技有限公司是一家专注肿瘤免疫靶点相关抗体分子发现的创新型生物技术公司。公司的功能性蛋白表达平台和DimAb®重组抗体开发平台的完美结合,可满足药企临床前抗体分子发现的迫切需求。
缔码生物独有的DimAb®重组单克隆抗体种子库发现平台,能够高效而快速的分离出功能性抗体分泌的B细胞,并克隆其抗体基因序列。
另外,公司建立的抗体工程改造平台和抗体药效评价体系可以为药企客户提供一体化、全方位的临床前研发解决方案。

缔码生物
DIMA Biotechnology LTD
电话:18062749453
邮箱:info@dimabio.cn
网址:www.dimabio.cn

原文始发于微信公众号(缔码生物):锌转运蛋白LIV-1能否带来“锌”机遇?