自从2016年ASCO大会上,Ganymed公布了其核心药物anti-claudin 18.2单抗Zolbetuximab(IMAB362)治疗晚期胃及胃食管交界处腺癌的疗效数据后,Claudin 18.2成为了药企们争相研发的方向之一,技术路线包含单抗、双抗、ADC和CAR-T。同年10月,安斯泰来以12.8亿欧元火速收购Ganymed,从而获得Zolbetuximab进一步商业化权利。2024年3月26日,依然是Zolbetuximab,成为了全球首款获批的Claudin18.2抗体,获得日本厚生劳动省(MHLW)批准用于治疗CLDN18.2阳性、不可切除、晚期或复发性胃癌患者。这无疑是给布局Claudin 18.2靶点管线的药企们一针强心剂,也再次把Claudin 18.2推上了热门靶点行列。那Claudin18.2究竟是什么?目前靶向Claudin 18.2的其他疗法进展又是如何?
1、Claudin18.2与Claudins
Claudin18.2(又称CLDN18.2)属于Claudins蛋白家族。Claudins家族是一类存在于上皮和内皮紧密连接中的整合素膜蛋白,目前在哺乳动物中至少发现了27个该蛋白家族成员,根据序列的相似性可分为经典和非经典的Claduins。经典紧密蛋白包括Claudin1、Claudin2、Claudin3、Claudin4、Claudin5、Claudin6、Claudin7、Claudin8、Claudin9、Claudin10、Claudin14、Claudin15、Claudin17、Claudin19,非经典紧密蛋白包括Claduins 11-13、16、18和20-24。Claudins是构成紧密连接最关键的蛋白之一。紧密连接(tight junction,TJs)是正常上皮细胞与细胞黏附的重要功能组成部分,它们通过机械的方式连接细胞,形成上皮屏障,阻止细胞间的大分子运输,维持上皮细胞极性。
如Figure 1所示,Claudin蛋白为4次跨膜蛋白,分为细胞膜内侧和细胞膜外侧。Claudin蛋白N端和C端均位于细胞膜内侧。其N端较短,约7个氨基酸,C端则约包含25-55个氨基酸。claudin的细胞质尾部(N端)包含几个翻译后修饰的重要位点,包括磷酸化、棕榈酰化和SUMO化。C端包含一个PDZ结合基序(YV),通过YV可与包含PDZ结构域的蛋白质结合。细胞膜外侧包含2个ECL结构域:ECL1结构域约包含50个氨基酸,ECL2结构域约包含25个氨基酸。
Claudin蛋白的结构使得Claudins紧密蛋白家族能够有效维持上皮细胞和内皮细胞的极性。Claudin蛋白介导的紧密连接是通过不同细胞之间的Claudin蛋白多聚体来实现的。紧密连接已被证实是细胞旁通透性的主要决定因素。Claudins蛋白主要在上皮细胞中表达,它的功能主要是调节屏障结构的渗透性。
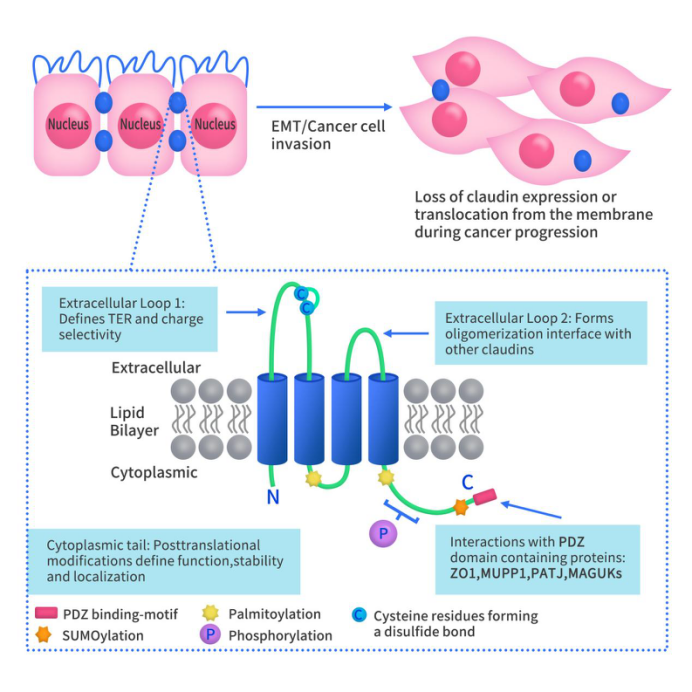
Figure 1. the structure of Claudins [1] [2]
2、Claudin18.2表达
目前,在哺乳动物中Claudin家族蛋白有27个成员。Claudin-18剪接变异体2 (CLDN18.2)是一种胃特异性的紧密连接蛋白,在许多癌症中都有表达。Claudin18.2在乳腺癌、结肠癌、肝癌、头颈癌、支气管癌以及非小细胞肺癌等多种原发恶性肿瘤中异常激活和过度表达,尤其好发于消化系统恶性肿瘤,包括胃癌(70%),胰腺癌(50%),食管癌(30%)等。在肿瘤中,Claudin18.2参与肿瘤细胞的增殖分化和迁移。在正常组织中,细胞间紧密粘连,抗体药物极难与其结合。这就减少了Claudin18.2药物对正常组织的影响。而恶性肿瘤的发生会导致紧密连接的破坏,使肿瘤细胞表面的Claudin18.2表位暴露出来,从而可与Claudin18.2大分子药物结合。Claudin18.2的特性(高度选择性,只在癌细胞中广泛表达)使得它成为一个理想的肿瘤免疫靶点。目前靶向Claudin18.2靶点的研究中多以胃癌为主。
3、Claudin18.2靶向治疗研究进展
Claudin18.1是CLDN18的另一个剪切体,Claudin18.1与Claudin18.2结构相似,仅仅在胞外结构域ECL1序列上有7个氨基酸残基的差异,所以要开发只特异性识别Claudin18.2,而不识别Claudin18.1的抗体就成为Claudin18.2抗体开发的难点所在。目前,临床上开发的关于Claudin18.2靶向疗法涉及多种类型,包括单克隆抗体、双特异性抗体、ADC和CAR-T细胞疗法,其中以Claudin18.2单克隆抗体药物最多,其次是ADC药物。
3.1 Claudin18.2单克隆抗体
Zolbetuximab,又称为GC-182,iMAB-362,是由Ganymed原研的一款靶向CLDN18.2的IgG1单克隆抗体。该抗体药已于2024年3月27日获得日本厚生劳动省(MHLW)批准上市,用于治疗CLDN18.2阳性、不可切除、晚期或复发性胃癌患者。Zolbetuximab(商品名为Vyloy)是首个获得全球监管机构批准的CLDN18.2靶向疗法。zolbetuximab的此次获批主要是基于SPOTLIGHT(NCT03504397)和GLOW(NCT03653507)临床III期试验的积极结果。其中,SPOTLIGHT试验评估了zolbetuximab联合mFOLFOX6疗效果。mFOLFOX6是一种联合治疗方案,包括奥沙利铂、亚叶酸钙和氟尿嘧啶。GLOW试验则评估了zolbetuximab联合CAPOX与安慰剂联合CAPOX相比的治疗效果。CAPOX是一种联合化疗方案,包括卡培他滨和奥沙利铂。
LM-102是由礼新医药自主研发的CLDN18.2单克隆抗体药物。2021年初,LM-102取得美国FDA IND批件并在美国成功完成第⼀位受试患者用药。本研究(NCT04735796)是一项开放标签、剂量爬升I期临床研究,用以评估LM-102注射液在实体瘤患者中的安全性、耐受性、药代动力学、免疫原性和初步抗肿瘤活性。2021年10月,礼新医药Claudin18.2抗体LM-102在中国大陆开展II期临床试验(NCT05008445)。本研究是一项评价LM-102注射液单药或联合治疗在 CLDN18.2阳性的晚期实体瘤患者中的安全性、耐受性、药代动力学、免疫原性和抗肿瘤活性的开放、多中心的 I/II期临床研究,由复旦大学附属中山医院牵头实施。但目前该项临床研究显示状态为终止,原因暂未披露。
ASKB589是奥赛康自主研发的一款人源化Claudin18.2IgG1单克隆抗体,主要是通过ADCC和CDC杀伤肿瘤细胞。2020年7月,ASKB589首次收到NMPA的临床申请许可并开展I/II期临床研究(NCT05632939)。这是一项ASKB589与卡培他滨、奥沙利铂(CAPOX)和信迪利单抗联合应用作为G/GEJ腺癌的一线治疗的进行中的Ib/IIa期剂量爬坡和扩展研究。研究结果显示,ASKB589在6mg/kg和10mg/kg的剂量与CAPOX和抗PD1治疗的药代动力学一致,具有可管理的安全性和有望的抗肿瘤活性。6mg/kg被选为后续研究的推荐剂量。2023年10月,奥赛康宣布ASKB589已获得NMPA药品审评中心(CDE)批准,开展评价ASKB589注射液或安慰剂联合CAPOX(奥沙利铂和卡培他滨)及PD-1抑制剂一线治疗CLDN18.2 阳性的不可切除的局部晚期、复发性或转移性胃及食管胃交界处腺癌患者的有效性和安全性的III期临床研究(NCT06206733)。目前该项研究正处于招募状态。该项研究的获批也标志着ASKB589药物胃癌关键性临床研究的前沿。
AB011是由科济药业自主研发的重组人源化Claudin 18.2单克隆抗体药物,用于治疗CLDN18.2阳性实体瘤。它是我国自主研发的首个针对该靶点的单抗,也是国际上首个针对该靶点的人源化单抗。临床前研究显示有显著的抑瘤效果。目前,AB011正在中国开展治疗Claudin18.2阳性实体瘤的I期临床研究(NCT04400383
)。
MIL93是由天广实生物开发的一款靶向Claudin 18.2的重组人源化单克隆抗体,拟开发用于治疗Claudin 18.2阳性胃癌、胰腺癌。公司对MIL93的Fc段进行改造,使其与NK细胞上表达的FcγRIIIa具有更高的亲和力,从而使其ADCC作用比同类候选药物高达百倍。目前,MIL93正在临床上开展一项评价重组人源化单克隆抗体 MIL93 注射液治疗局部晚期或转移性实体瘤的耐受性、 安全性、 药代动力学和初步疗效的 I 期临床研究(NCT04671875),该项研究正处于招募状态。
M108是由明济生物开发的一款Claudin 18.2单抗,是我国自主研发针对胃癌等消化系统癌症肿瘤抗原高表达的ADCC增强型单克隆抗体。在体外和体内的抗体药效及理化性质等检测中,M108单抗注射液展示了较高的靶点特异性结合、较强的抗肿瘤活性和很好的安全性。M108正在临床上开展一项的Ⅰ期临床研究(NCT04894825),旨在评估M108单药和联合化疗治疗的安全性及耐受性、药代动力学、免疫原性和初步疗效,包括M108单药剂量递增和扩展研究及M108联合化疗剂量递增和扩展研究。目前该项研究还处于招募状态。
QL1779是由齐鲁制药通过杂交瘤技术制备的Claudin 18.2人源化抗体。2021年4月23日,齐鲁制药QL1779的临床实验申请获得NMPA的默示许可,用于治疗实体瘤患者。
TST001,又称为Osemitamab,是由创胜集团开发的第二代靶向CLDN18.2的人源化抗体,具有改善的CLDN18.2结合亲和力和增强的抗体依赖性细胞毒性(ADCC)。其在具有广泛CLDN18.2表达的临床前肿瘤模型中显示出抗肿瘤活性。在2023年度ASCO年会及ESMO GI会议上,创胜集团展示了Osemitamab (TST001)联合CAPOX作为胃癌或胃食管结合部腺癌一线治疗的令人鼓舞的疗效数据。2023年10月,FDA批准创胜集团开展Osemitamab (TST001)联合纳武利尤单抗及化疗作为HER2阴性、CLDN18.2表达局部晚期或转移性胃癌或胃食管结合部腺癌(G/GEJ)患者一线治疗的TranStar 301全球III期关键性试验(NCT06093425)。目前,该项研究还未启动患者招募。
NBL-015是由上海新石生物开发的一种全人源抗Claudin-18.2单克隆抗体,经过蛋白工程改造获得优化的ADCC,CDC和ADCP效应。临床前体外细胞杀伤实验、动物胰腺癌肿瘤消除实验及毒性研究均显示NBL-015较同类药物具有免疫原性低、安全性好、亲和力强、抗肿瘤活性高的显着优势。目前针对该药正在开展一项评价NBL-015注射液在晚期实体瘤患者的安全性、耐受性、药代动力学特征以及初步疗效的多中心、开放的Ⅰ期临床试验(NCT05153096),该试验还未启动招募。
3.2 Claudin18.2双特异性抗体
Q-1802是启愈生物开发的一款CLDN18.2/PD-L1双特异性抗体。Q-1802一方面可以通过Claudin18.2抗体介导的效应细胞杀伤肿瘤,另一方面通过PD-L1抗体阻断PD-1信号,同时激活天然免疫和适应性免疫反应。2020年12月14,国家药监局药审中心受理了Q-1802的临床试验申请。Q-1802成为全球首个获美国FDA IND 批准的Claudin18.2/PD-L1双特异性抗体。目前启愈生物正在针对Q-1802开展两项临床试验,NCT04856150(I期)和NCT05964543(I/II期)。
ABL-111,又称为TJ-CD4B、TJ033721,是天境生物开发的一款同时靶向Claudin 18.2和4-1BB的创新双特异性抗体。在Claudin18.2低表达的情况下,它仍能与肿瘤细胞结合,并产生优于其它4-1BB单克隆抗体的免疫活性。ABL111具有独特的4-1BB结合表位,使其仅在与Claudin18.2结合时才会激活T细胞,避免因4-1BB广泛表达而过度激活T细胞所引起的肝毒性和降低全身免疫反应风险。目前,天境生物在美国开展的I期临床研究(NCT04900818),评估ABL-111治疗晚期或转移性实体瘤患者的安全性、耐受性、药代动力学和药效学。
AMG910是安进和百济神州联合开发的一款同时靶向CLDN18.2和CD3的双特异性T细胞接合剂(BiTE)分子的Claudin18.2/CD3双特异性抗体。目前,这款药物已开展适应症为胃癌和胃食管交界腺癌的全球多中心I期临床试验(NCT04260191)。
3.3 Claudin18.2 ADC
LM302是一个礼新医药拥有自主知识产权和全球权益的基于Claudin 18.2抗体偶联药物的I类新药。LM-302能特异靶向Claudin 18.2阳性的肿瘤细胞并通过内吞进入肿瘤细胞,释放小分子毒素,从而起到抗肿瘤作用。LM-302临床前研究数据显示出良好的安全性及体内外活性,尤其在Claudin 18.2低表达的肿瘤模型中也显示出良好的药效。
2021年6月,该项目已经先期取得美国FDA IND批件,并获得FDA孤⼉药资格认定(胰腺癌,胃癌及胃⻝管交界部癌)。2021年10月14日,LM-302抗体偶联药物项目正式取得中国NMPA IND批件。目前正在进行的临床项目有三项,Clinicaltrials.gov上显示的最高临床阶段为临床II期,但值得注意的是,礼新医药官网显示的阶段为临床III期。
SYSA1801是石药集团研发的重组抗人CLDN18.2单克隆抗体-MMAE偶联药物。目前处于临床一期,拟用于治疗晚期实体瘤患者。临床前体外和体内的动物实验显示SYSA1801能有效通过抗Claudin-18.2抗体靶向肿瘤细胞并发生内吞,将MMAE毒素带入肿瘤细胞而起到治疗胃癌和胰腺癌的作用。该研究(NCT05009966)是一项开放标签、剂量递增和扩展的I期多中心研究,旨在评估SYSA1801治疗CLDN18.2表达(定义为CLDN18.2 IHC≥1+)晚期恶性实体瘤患者的安全性、耐受性、药代动力学特征、免疫原性和初步疗效。在2023年度ASCO大会上,北京大学肿瘤医院沈琳教授团队成员王雅坤医生展示了SYSA1801治疗CLDN18.2表达复发或难治性晚期实体瘤的首次人体研究的疗效和安全性,初步结果在胃癌患者中呈现良好的疗效。
CMG901,亦称 AZD0901,是康诺亚生物开发的一款靶向Claudin 18.2的抗体偶联药物,含Claudin 18.2特异性抗体、可裂解连接子及毒性载荷单甲基澳瑞他汀E (MMAE)。拟用于治疗实体瘤、胃癌及胃食管结合部(GEJ)癌,目前正处于临床I期研究阶段。在2023年11月ASCO会议上,康诺亚以口头报告形式展示了CMG901治疗晚期胃癌/胃食管结合部腺癌的I期临床研究(NCT04805307)最新数据。该研究的目的是评价CMG901在晚期实体瘤受试者中的安全性和耐受性、药代动力学特征、免疫原性及初步有效性。在本次研究中,CMG901表现出了良好的安全性和耐受性,绝大部分不良事件在处理后可继续用药。CMG901在治疗晚期Claudin18.2阳性胃癌/胃食管结合部腺癌患者中表现出了优秀的疗效。
ATG-022是由上海德琪医药开发的一款抗Claudin 18.2抗原的人源化IgG1抗体偶联药物,适应症是实体瘤。由于其独特的作用机制和对肿瘤的高特异性,公司认为ATG-022具有与其他管线资产联用的潜力,也可作为肿瘤识别双特异性抗体组。2023年3月14日,ATG-022药物临床试验在中国获批,该I期CLINCH研究旨在评估ATG-022单药治疗晚期或转移性实体瘤患者的安全性、药理特性及初步疗效。
3.4 Claudin18.2 CAR-T
CT041是科济生物自主研发的一款人源化抗Claudin18.2自体CAR-T细胞疗法。2020年5月,CT041的新药临床试验(IND)申请获得美国FDA许可,这是国际上首个针对Claudin18.2靶点开发的CAR-T细胞候选药品临床试验许可。2020年8月,该产品首次在中国获批临床。目前已启动CT041自体CAR-T细胞注射液在晚期胃/食管胃结合部腺癌和胰腺癌受试者中的Ib/II期临床试验。
2021年9月19日,EMSO年会上公布的数据表明CT041在难治性CLDN18.2阳性消化道肿瘤患者中显示出良好的安全性和有前景的抗肿瘤活性。2024年1月19日,科济生物在ASCO GI展示了一篇靶向Claudin18.2自体CAR-T细胞疗法CT041(satri-cel)的临床研究,该文章主要报告了在美国进行的用于治疗胃癌/食管胃结合部腺癌(GC/GEJ)或胰腺癌(PC)的ELIMYN18.2 1b期临床试验剂量爬坡阶段(队列A)的结果。结果显示,CT041既往经多重治疗的Claudin18.2阳性晚期GC/GEJ和PC患者中显示出有前景的初步疗效。
LB1908是由传奇生物开发的靶向Claudin18.2的CAR-T细胞疗法,它是传奇生物利用VHH抗体平台开发的靶向CLDN18.2的VHH(Variable domain of heavy chain of heavy chain antibody)抗体。LB1908可高亲和力结合Claudin18.2,它仅对表达CLDN18.2的细胞具有细胞毒性,但对人类原代细胞或表达Claudin 18.1的细胞没有细胞毒性。目前LB1908已经进入临床I期试验(NCT05539430),用于治疗胃癌或胰腺癌。
4、缔码Claudin18.2相关产品助力Claudin18.2生物药研发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。针对Claudin18.2,缔码生物已开发多个Claudin18.2重组蛋白(全长&ECD蛋白)及流式验证抗体产品。此外,为助力Claudin18.2生物药研发,缔码生物已针对Claudin18.2制备B细胞种子库,最快28天可筛选抗体先导分子;另,针对部分现有的抗体先导分子,缔码生物进行了抗体内吞及杀伤试验,具体数据欢迎垂询。
- 特色产品
Fluorescent Human CLDN18.2 Full Length Protein-VLP (EGFP) (FLP100017)
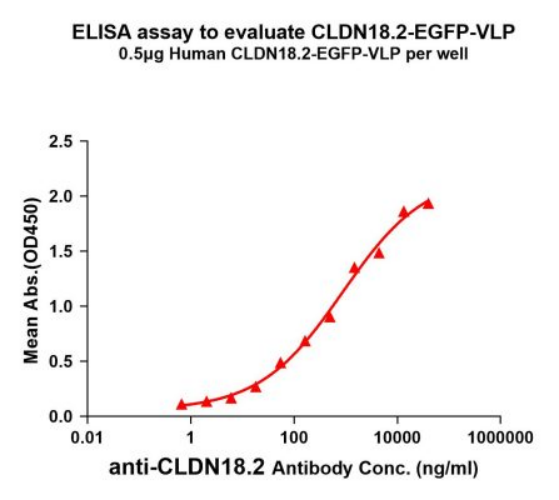
Figure 2. ELISA plates were pre-coated with 0.5μg/per well purified human CLDN18.2-EGFP-VLP. Serial diluted Anti-CLDN18.2 monoclonal antibody (BME100075) solutions were added, washed, and incubated with secondary antibody before ELISA reading. From above data, the EC50 for anti- CLDN18.2 monoclonal antibody binding with CLDN18.2-EGFP-VLP is 877.5ng/ml.
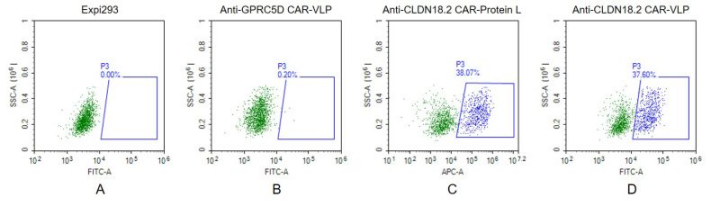
Figure 3. FACS analysis of CLDN18.2 VLP.
A. Negative Control 1: Expi293 cells were stained with Fluorescent Human CLDN18.2 Full Length Protein-VLP (EGFP).
B. Negative Control 2: Anti-GPRC5D-CAR-Expi293 cells (an irrelevant CAR) were stained with Fluorescent Human CLDN18.2 Full Length Protein-VLP (EGFP).
C. Positive Control: Anti-CLDN18.2-CAR-Expi293 cells were stained with biotin labeled Protein L, followed by streptavidin-APC antibody.
D. Anti-CLDN18.2-CAR-Expi293 cells were stained with Fluorescent Human CLDN18.2 Full Length Protein-VLP (EGFP).
- 产品列表
| 产品类型 | 产品货号 | 产品名称 |
| 全长蛋白 | FLP200014 | Human CLDN18.2 full length protein-MNP |
| 全长蛋白 | FLP100014 | Human CLDN18.2 full length protein-synthetic nanodisc |
| 全长蛋白 | FLP100006 | Human CLDN18.2 full length protein-VLP |
| 全长蛋白 | FLP100017 | Fluorescent Human CLDN18.2 Full Length Protein-VLP (EGFP) |
| ECD蛋白 | PME-C100050 | Cynomolgus CLDN18.2 Protein, hFc Tag |
| 流式验证抗体 | DME100179 | Anti-CLDN18.2 antibody(DM179); Rabbit mAb |
| 参照抗体 | BME100075 | Anti-CLDN18.2 (zolbetuximab biosimilar) mAb |
- 抗体先导分子研究进展

参考文献:
[1]Mathews LS, Vale WW: Expression cloning of an activin receptor, a predicted transmembrane serine kinase. Cell. 1991, 65: 973-982.
[2]Harrison CA, Gray PC, Vale WW, Robertson DM: Antagonists of activin signaling: mechanisms and potential biological applications. Trends Endocrinol Metab. 2005, 16: 73-78.
[3]Feng XH, Derynck R: Specificity and versatility in tgf-beta signaling through Smads. Annu Rev Cell Dev Biol. 2005, 21: 659-693.
[4] J.L. Wrana, L. Attisano, R. Wieser, F. Ventura, J. Massague, Mechanism of activation of the TGF-beta receptor. Nature, 370, 6488 (1994), 341– 347.
[5]M. Huse, T.W. Muir, L. Xu, Y.G. Chen, J. Kuriyan, J. Massague, The TGF beta receptor activation process: an inhibitor- to substrate-binding switch. Mol. Cell, 8, 3 (2001), 671– 682.
